医疗质量检测技术展|医疗器械软件出厂检是不是不需要功能检验?
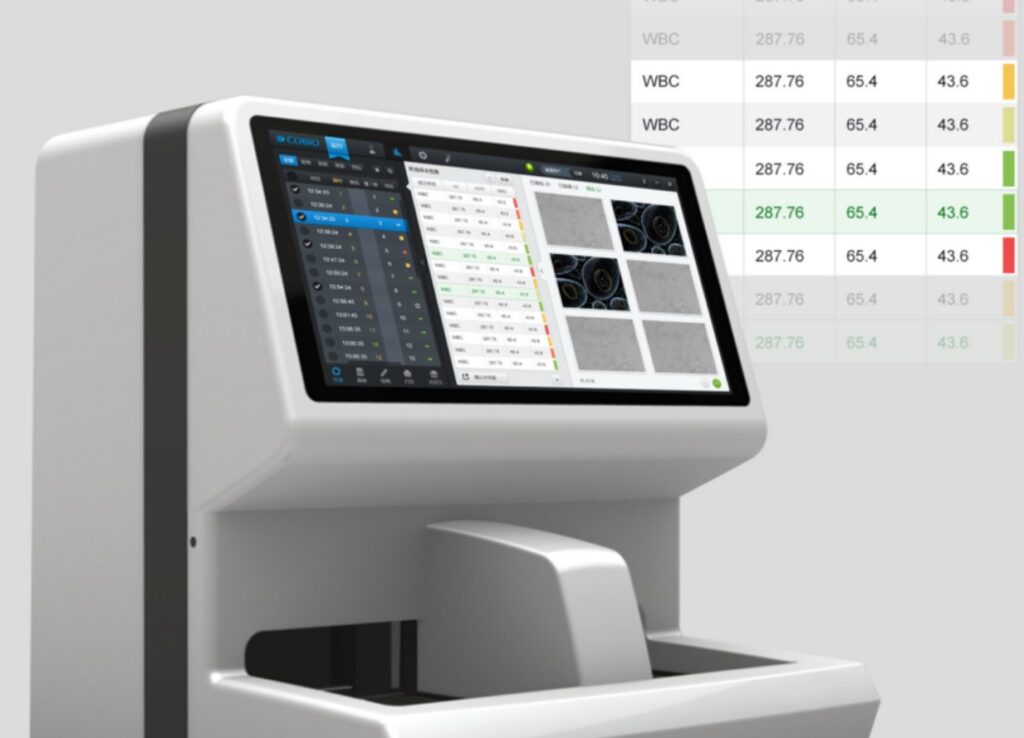
按照《医疗器械生产企业质量控制与成品放行指南》的相关要求,成品检验规程的内容原则上应当覆盖已注册或者备案的产品技术要求中需要常规控制的检验项目和检验方法。对于带软件组件的产品或独立软件,在技术要求中会列出部分软件功能。在设计开发阶段,独立软件已完成功能性能的系统测试验证。在生产阶段基本是一个软件组件的部署或者是独立软件交付物的拷贝过程,在出厂检验中是否可以不对软件功能进行再次测试?
医疗质量检测技术展|医疗器械软件注册检验要点及方法研究
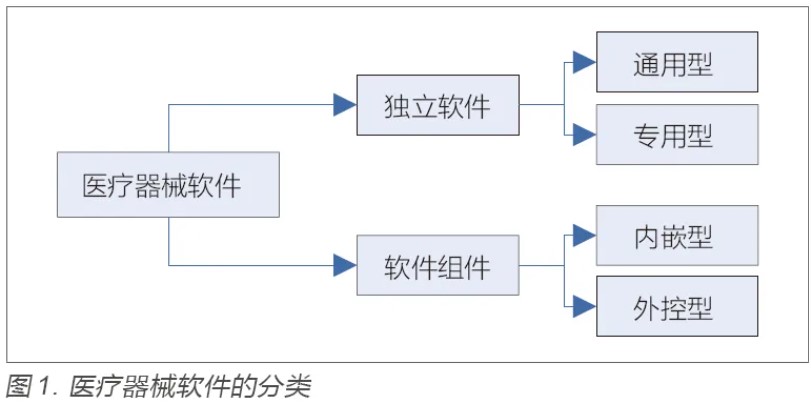
目的:针对医疗器械软件注册检验要点和检测方法进行研究,为加强医疗器械软件的质量保证工作提供参考。方法:以医疗器械软件注册指导原则为基础,梳理不同医疗器械软件的特点和分类,明确软件产品技术要求的编制指南,并且结合通用要求、质量要求、专用要求、安全要求四个方面的要求,对注册检验内容进行解读,最后总结常用检测方法和检测工具。结果:梳理的医疗器械软件注册检验要点可以为注册申请人编写产品技术要求提供指导,总结的检验方法和检测工具可以给检测机构开展相关评测提供借鉴。结论:医疗器械软件检验应从通用要求、质量要求、专用要求和安全要求四个方面进行,检测主要涉及功能测试和性能测试两大类,性能测试通常需借助专业工具进行。
医疗质量检测技术展|医疗器械原材料变更的基本流程

医疗器械的预期用途、技术要求、安全有效性、有效期等等,很大程度上取决于原材料。
产品注册时确定下来的原材料,轻易不能变化。
但是,企业在实际经营过程中,常常为了降低成本、改善某方面性能、完善供应链、符合升版的标准,或主动、或被动地对原材料进行变更。
上海医疗检测设备展|关于医疗器械与计量的那些事

计量是关于测量的科学,是实现单位统一、量值准确可靠和与国际一致的科学和管理活动,其目的是为了保证测量结果的准确可靠。
医疗质量检测技术展|医疗器械注册检验常见问题答疑汇总

A:维氏硬度检测不需要提供单独的试样,在送检样品上取样测试;洛氏硬度检测若被测部位形状不规则时,无法直接对样品进行测试,应提供原材料试样块,并提供材质、热处理工艺一致性声明。
上海医疗检测设备展|一文了解医疗器械发光测定仪是什么

高灵敏度:化学发光测定技术具有很高的灵敏度,能够检测到低浓度的生物分子,适用于早期疾病的诊断。
医疗质量检测技术展|医械生物相容性评价的目标和方法

根据ISO 10993-1:2018的定义,生物相容性是指医疗器械或材料在一个特定应用中引起恰当宿主反应的能力。“生物相容”与“生物不相容”不是某种材料天然的或绝对的“标签”,而是需要结合材料的具体性能和特定的(临床)应用场景进行判断。同时,生物相容性是一个动态概念,植入物植入人体后会对特定生物组织环境产生物理和化学影响,引起生物学反应;反之,生物组织也会对植入物产生影响,使之发生物理或化学变化,两者的相互作用会一直持续。即使植入物被完全去除或被人体完全吸收,其影响还将持续一段时间。
医疗质量检测技术展|质量部DQE、SQE、CQE、PQE 岗位职责有哪些?
DQE是在产品设计和开发过程中负责质量管理和质量保证的专业人员。他们的主要职责是确保产品设计符合质量标准和客户要求。以下是DQE设计质量工程师的常见工作职责:
1. 质量计划和策略:制定和执行产品设计和开发阶段的质量计划和策略,确保产品符合质量标准和规范。
医疗质量检测技术展|金属材料的力学性能总结
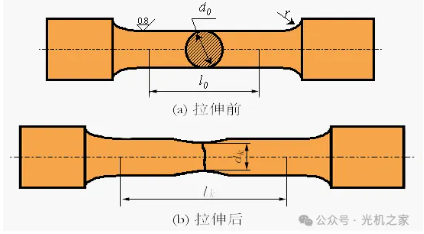
强度的拉伸试验测试主要用于测定金属材料在拉伸过程中抵抗破坏的能力,是评价材料力学性能的重要指标之一。
医疗器械行业展览|减轻医疗器械供应链中的产品责任风险

当身处错综复杂的全球化时代,当网络支配着所有的商业脉搏,当患者因医疗器械产品组件故障而受伤,当不熟悉供应链中的所有环节,结果将令人望而生畏。






