医疗质量检测技术及测试仪器展|QMSR质量体系到底是怎么回事?

QMSR的征求意见稿于2022年的2月发布,正式版本于2024年2月发布,2026年2月2日生效,制造商有两年的时间来调整内部流程和程序。美国FDA医疗器械质量体系法规俗称为QSR820。其中820是指的是美国联邦法规的第820章节。Q代表quality,S代表system,R代表regulation。
医疗质量检测技术及测试仪器展|医疗器械GMP对“空调净化系统”的要求

医疗器械的生产过程和加工工序必须在洁净室(区)内进行,并达到规定的洁净度级别要求,不同医疗器械适用的洁净度级别要求不一致。对洁净室(区)的工作环境必须严格控制,才能有效地防止工作环境对医疗器械的污染,保证产品质量和使用者安全。而洁净度级别的控制主要通过空调净化系统的科学合理选择、设计、维护实现。
医疗质量检测技术展|医械生物相容性评价的目标和方法

根据ISO 10993-1:2018的定义,生物相容性是指医疗器械或材料在一个特定应用中引起恰当宿主反应的能力。“生物相容”与“生物不相容”不是某种材料天然的或绝对的“标签”,而是需要结合材料的具体性能和特定的(临床)应用场景进行判断。同时,生物相容性是一个动态概念,植入物植入人体后会对特定生物组织环境产生物理和化学影响,引起生物学反应;反之,生物组织也会对植入物产生影响,使之发生物理或化学变化,两者的相互作用会一直持续。即使植入物被完全去除或被人体完全吸收,其影响还将持续一段时间。
医疗质量检测技术展|QMSR质量体系到底是怎么回事?
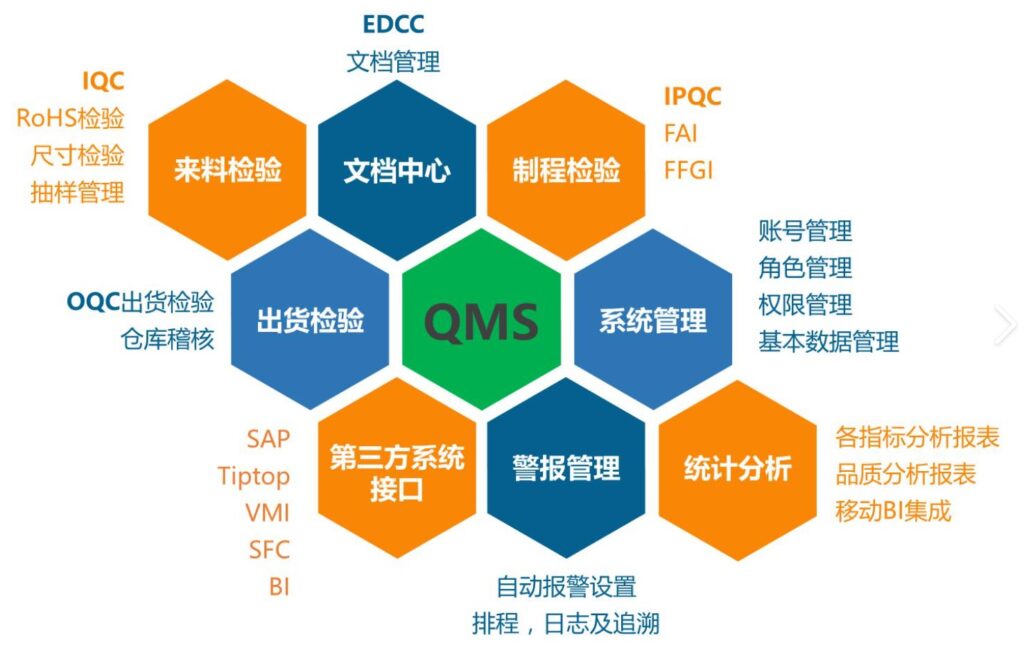
MSR的征求意见稿于2022年的2月发布,正式版本于2024年2月发布,2026年2月2日生效,制造商有两年的时间来调整内部流程和程序。美国FDA医疗器械质量体系法规俗称为QSR820。其中820是指的是美国联邦法规的第820章节。Q代表quality,S代表system,R代表regulation。美国FDA对QSR820质量体系进行修订,引进了国际标准化组织ISO13485-2016版本取代现有的大部分法规,更改后的质量体系新规叫做:QMSR(Quality Management System Regulation)
上海医疗检测设备展|医疗器械认证过程中的风险管理要点

当我们谈论医疗器械行业的风险管理时,有些人可能会认为这是一个令人生畏的混乱过程。一开始可能会让人不知所措,但这对确保我们开发的器械在整个生命周期内安全有效至关重要。这不仅仅是为了满足监管要求—虽然这绝对是其中的一部分—而是为了做出明智的决策,保护患者并降低器械失效的可能性。
上海医疗测试仪器展|医疗器械安全性评价的总体框架要点梳理

医疗器械安全性评价的内容较为繁杂,安全性评价有共性部分,也有差异部分,产品不同,评价内容不同,评价重点不同。
识别安全性问题的来源,是进行安全性评价的基础。医界内参老师整理了安全性评价的整体思路和框架,加入了我平台老师自己的经验和理解,以促进从业朋友对医疗器械安全性评价内容的概要理解。
医疗质量检测技术及测试仪器展|如何进行立式灭菌锅验证

立式灭菌锅多用于QC实验室,主要用于部件、培养基等的灭菌。
今天主要聊下常见的一些测试项目。
医疗质量检测技术展|质量部DQE、SQE、CQE、PQE 岗位职责有哪些?
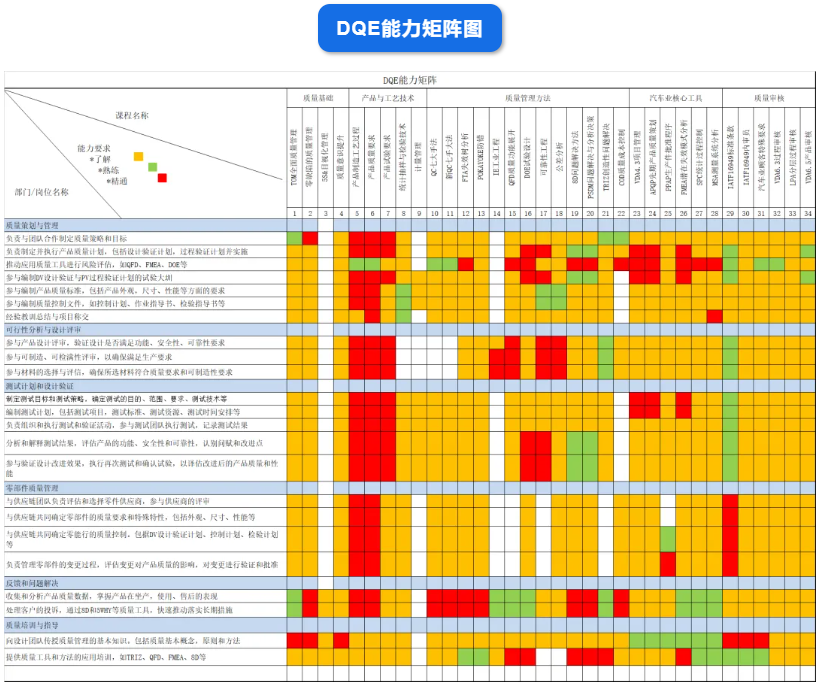
DQE是在产品设计和开发过程中负责质量管理和质量保证的专业人员。他们的主要职责是确保产品设计符合质量标准和客户要求。以下是DQE设计质量工程师的常见工作职责:
1. 质量计划和策略:制定和执行产品设计和开发阶段的质量计划和策略,确保产品符合质量标准和规范。
医疗质量检测技术展|光学系统的焦距定义与测试方法
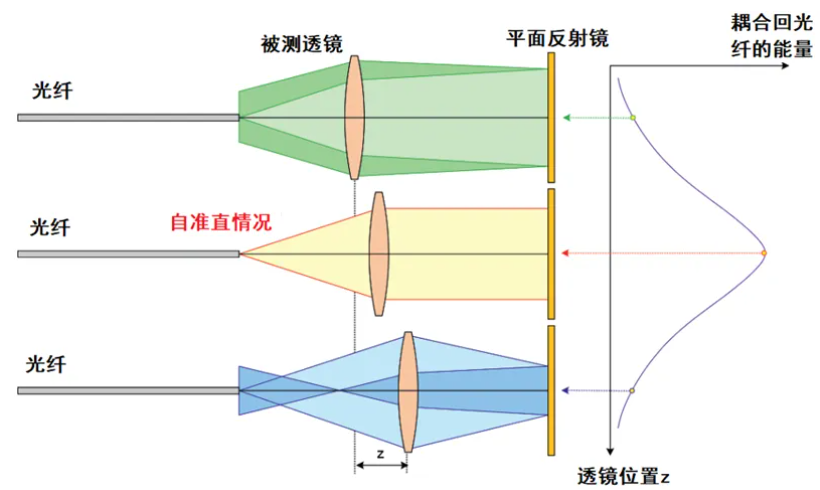
焦距是光学系统的一个非常重要的指标,对于焦距的概念,大家或多或少都有了解,我们这里再回顾一下。
光学系统的焦距,定义为平行光入射时从光学系统的光学中心到光束聚焦点的距离,是衡量光学系统中光的聚集或发散的度量方式。我们用下面的图来说明这一概念。
医疗质量检测技术展|金属材料的力学性能总结
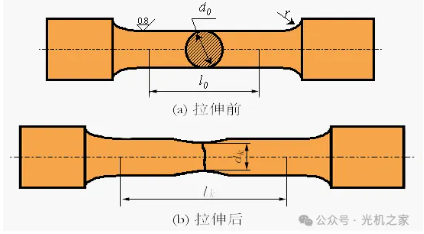
强度的拉伸试验测试主要用于测定金属材料在拉伸过程中抵抗破坏的能力,是评价材料力学性能的重要指标之一。






