医疗质量检测技术及测试仪器展|网络安全更新
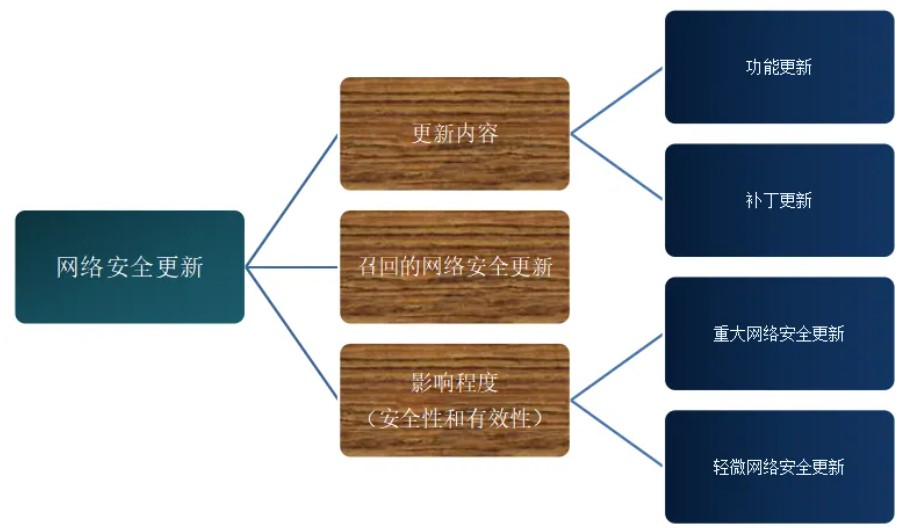
医疗器械网络安全更新从内容上可分为功能更新、补丁更新,类似于增强类软件更新、纠正类软件更新。
根据其对医疗器械安全性和有效性的影响程度分为以下两类:
医疗质量检测技术及测试仪器展|设计技术考量点
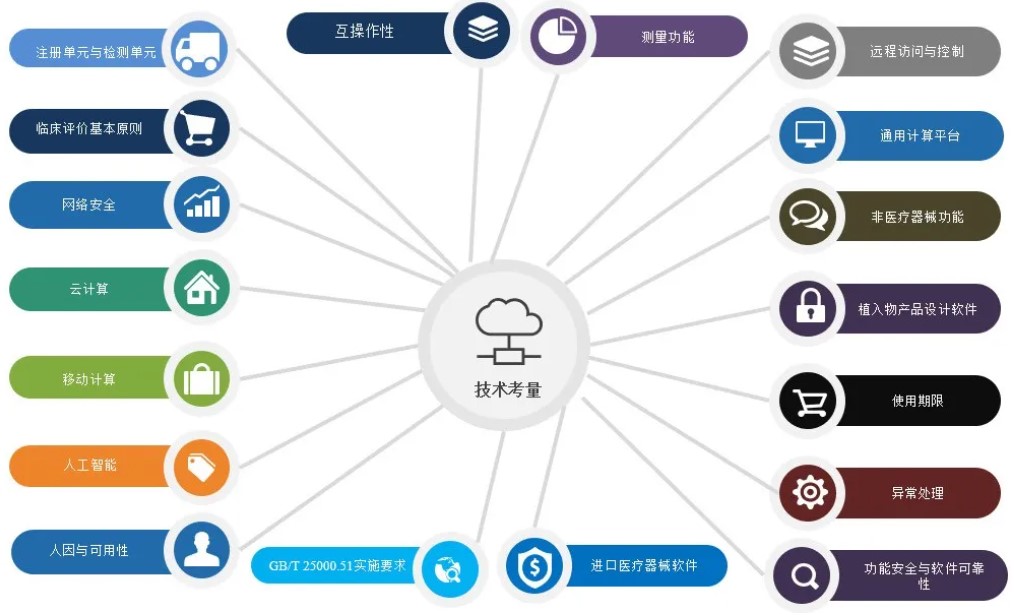
在进行医疗期器械软件设计过程中,我们可以从以下18点来进行技术考量。分别为1.注册单元与检测单元、2.临床评价基本原则、3.网络安全、4.云计算、5.移动计算、6.人工智能、7.人因与可用性、8.互操作性、9.测量功能、10.远程访问与控制、11.通用计算平台、12.非医疗器械功能、13.植入产品设计软件、14.使用期限、15.异常处理、16.功能安全与软件可靠性、17.GB/T25000.51实施要求和18.进口医疗器械软件等要求。
上海医疗测试仪器展|同品种医疗器械资料是否需要获取授权?
对于拟使用的同品种医疗器械非公开数据等需要提供授权,以保证数据来源的合法性;使用公开发表的数据,如公开发表的文献、数据、信息等,不需取得授权。数据如果来自公开数据、试验测量、行业共识等,不需取得授权。
医疗质量检测技术展|医疗器械原材料变更的基本流程

医疗器械的预期用途、技术要求、安全有效性、有效期等等,很大程度上取决于原材料。
产品注册时确定下来的原材料,轻易不能变化。
但是,企业在实际经营过程中,常常为了降低成本、改善某方面性能、完善供应链、符合升版的标准,或主动、或被动地对原材料进行变更。
医疗质量检测技术及测试仪器展|读懂GB9706医疗器械强制标准,离不开这5大问题!

GB9706.1-2020《医用电气设备 第1部分:基本安全和基本性能的通用要求》已经从2023年5月1日起开始实施。那么,企业在执行GB9706系列标准时经常遇到哪些问题?久顺收集汇总不少企业相关询问,本期一并解答。
上海医疗检测设备展|关于医疗器械与计量的那些事

计量是关于测量的科学,是实现单位统一、量值准确可靠和与国际一致的科学和管理活动,其目的是为了保证测量结果的准确可靠。
医疗质量检测技术及测试仪器展|医疗器械GMP:检验设备是否都需要校验

企业生产医疗器械时,为确认产品性能指标以及生产和检验环境的洁净度,需要对产品性能指标、洁净区环境、工艺用水、产品无菌性能、环氧乙烷残留量(EO灭菌)等进行检验。质量检验的结果是否准确可靠,取决于检验设备测量的结果的准确性,企业在使用检验设备时,需要提供客观证据,证明设备符合要求。
医疗质量检测技术展|医疗器械注册检验常见问题答疑汇总

A:维氏硬度检测不需要提供单独的试样,在送检样品上取样测试;洛氏硬度检测若被测部位形状不规则时,无法直接对样品进行测试,应提供原材料试样块,并提供材质、热处理工艺一致性声明。
上海医疗检测设备展|一文了解医疗器械发光测定仪是什么

高灵敏度:化学发光测定技术具有很高的灵敏度,能够检测到低浓度的生物分子,适用于早期疾病的诊断。
医疗质量检测技术展|医疗器械“体考”到底是什么?

《医疗器械生产监督管理办法》明确规定:医疗器械生产企业应当按照医疗器械生产质量管理规范的要求,建立质量管理体系并保持有效运行。申请人在申请产品注册时,受理注册申请的药品监督管理部门在产品技术审评时,认为有必要对质量管理体系进行核查的,会组织开展质量管理体系核查。






