医疗质量检测技术及测试仪器展|仪器校准标签有哪些常见错误?检查这几点就可以了

仪器校准以后,在仪器校准机构出具完校准证书以后,就会在所校准的仪器上贴上校准标签,校准标签上会有此次校准相关的信息,这些信息是提供给设备管理人员溯源以及巡查的参考,以方便相关人员 陈知道仪器上一次具体的校准情况信息,那么仪器校准标签有哪些常见错误?检查这几点就可以了。
医疗质量检测技术展|一文读懂我国医疗器械唯一标识UDI!

对于普通消费者而言,越来越多的人开始发现UDI的存在却并不了解其意义。但对于医疗器械从业者而言,UDI早已进入视野多年,UDI不仅仅只是一个专有名词,更是一个对生命健康有效监管的预警保障,也是从业者需要积极认识并应用实施的必备工具。
医疗质量检测技术及测试仪器展|设计技术考量点
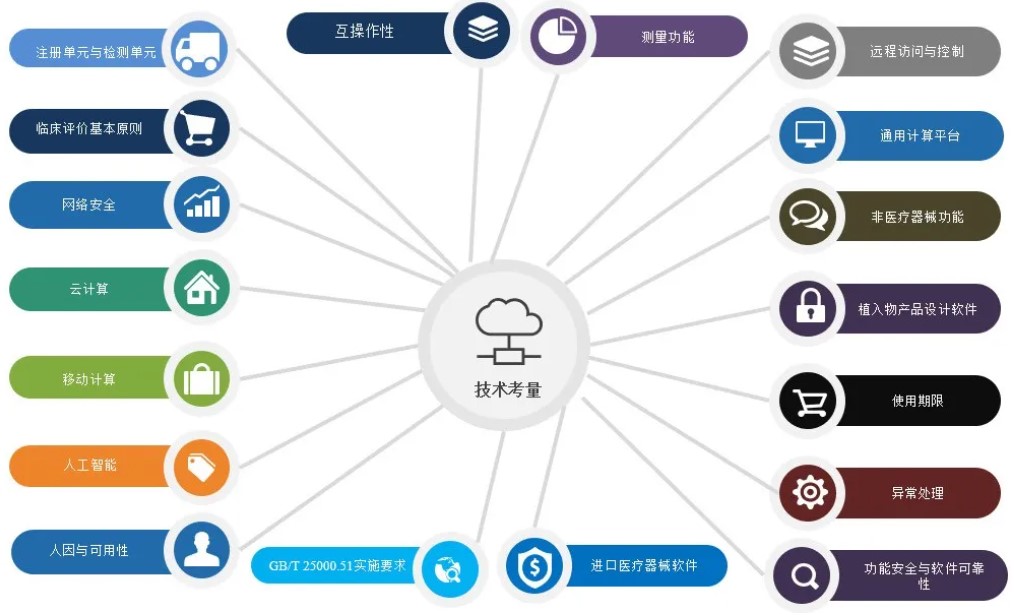
在进行医疗期器械软件设计过程中,我们可以从以下18点来进行技术考量。分别为1.注册单元与检测单元、2.临床评价基本原则、3.网络安全、4.云计算、5.移动计算、6.人工智能、7.人因与可用性、8.互操作性、9.测量功能、10.远程访问与控制、11.通用计算平台、12.非医疗器械功能、13.植入产品设计软件、14.使用期限、15.异常处理、16.功能安全与软件可靠性、17.GB/T25000.51实施要求和18.进口医疗器械软件等要求。
上海医疗测试仪器展|同品种医疗器械资料是否需要获取授权?
对于拟使用的同品种医疗器械非公开数据等需要提供授权,以保证数据来源的合法性;使用公开发表的数据,如公开发表的文献、数据、信息等,不需取得授权。数据如果来自公开数据、试验测量、行业共识等,不需取得授权。
医疗质量检测技术展|医疗器械原材料变更的基本流程

医疗器械的预期用途、技术要求、安全有效性、有效期等等,很大程度上取决于原材料。
产品注册时确定下来的原材料,轻易不能变化。
但是,企业在实际经营过程中,常常为了降低成本、改善某方面性能、完善供应链、符合升版的标准,或主动、或被动地对原材料进行变更。
医疗质量检测技术及测试仪器展|医疗器械生物相容性简介、流程、路径和数据
医疗器械生物相容性评价是确保医疗器械安全性和有效性的重要环节,它涉及到对医疗器械在与人体接触时可能产生的生物学反应和风险的全面评估。根据国家标准GB/T 16886.1-2022《医疗器械生物学评价 第1部分:风险管理过程中的评价与试验》,生物相容性评价应作为医疗器械总体评价和开发过程的一部分,贯穿于产品的全生命周期。
医疗质量检测技术及测试仪器展|读懂GB9706医疗器械强制标准,离不开这5大问题!

GB9706.1-2020《医用电气设备 第1部分:基本安全和基本性能的通用要求》已经从2023年5月1日起开始实施。那么,企业在执行GB9706系列标准时经常遇到哪些问题?久顺收集汇总不少企业相关询问,本期一并解答。
上海医疗检测设备展|关于医疗器械与计量的那些事

计量是关于测量的科学,是实现单位统一、量值准确可靠和与国际一致的科学和管理活动,其目的是为了保证测量结果的准确可靠。
医疗质量检测技术及测试仪器展|医疗器械GMP:检验设备是否都需要校验

企业生产医疗器械时,为确认产品性能指标以及生产和检验环境的洁净度,需要对产品性能指标、洁净区环境、工艺用水、产品无菌性能、环氧乙烷残留量(EO灭菌)等进行检验。质量检验的结果是否准确可靠,取决于检验设备测量的结果的准确性,企业在使用检验设备时,需要提供客观证据,证明设备符合要求。
医疗质量检测技术展|医疗器械注册检验常见问题答疑汇总

A:维氏硬度检测不需要提供单独的试样,在送检样品上取样测试;洛氏硬度检测若被测部位形状不规则时,无法直接对样品进行测试,应提供原材料试样块,并提供材质、热处理工艺一致性声明。






