上海医疗测试仪器展|ISO13485医疗器械质量管理标准 问与答 (一)

医疗器械质量管理体系起源于2000年我国发布的第22号医疗器械质量管理体系核查要求,并在此基础上历经九年发展形成了我国第一版医疗器械生产质量管理规范。随着医疗器械行业的快速发展,我国于2014年对GMP进行了修正并形成了最新的标准规范。同时,其他国家和地区也陆续建立了相应的质量管理体系标准法规,例如美国的CDMP及后续QSF20法规,欧盟的ENISO13485标准及其多次修订等。在70年代,美国率先制定了CDMP法规,并在其基础上于1996年发布针对质量管理体系要求的QSF20法规。欧盟则从1993年开始酝酿并报告了EN1N46001标准法规,但后来对该标准进行了修订和完善。国际标准化组织在1996年发布了基于ISO9001系列的两个医疗器械质量管理体系标准,即ISO13485:1996版与ISO13481:1996版,并随9001版本升级不断调整优化,最终在2016年发布了全新的ISO13485:2016版标准。
医疗质量检测技术及测试仪器展|QMSR质量体系到底是怎么回事?

QMSR的征求意见稿于2022年的2月发布,正式版本于2024年2月发布,2026年2月2日生效,制造商有两年的时间来调整内部流程和程序。美国FDA医疗器械质量体系法规俗称为QSR820。其中820是指的是美国联邦法规的第820章节。Q代表quality,S代表system,R代表regulation。
医疗质量检测技术展|QMSR质量体系到底是怎么回事?
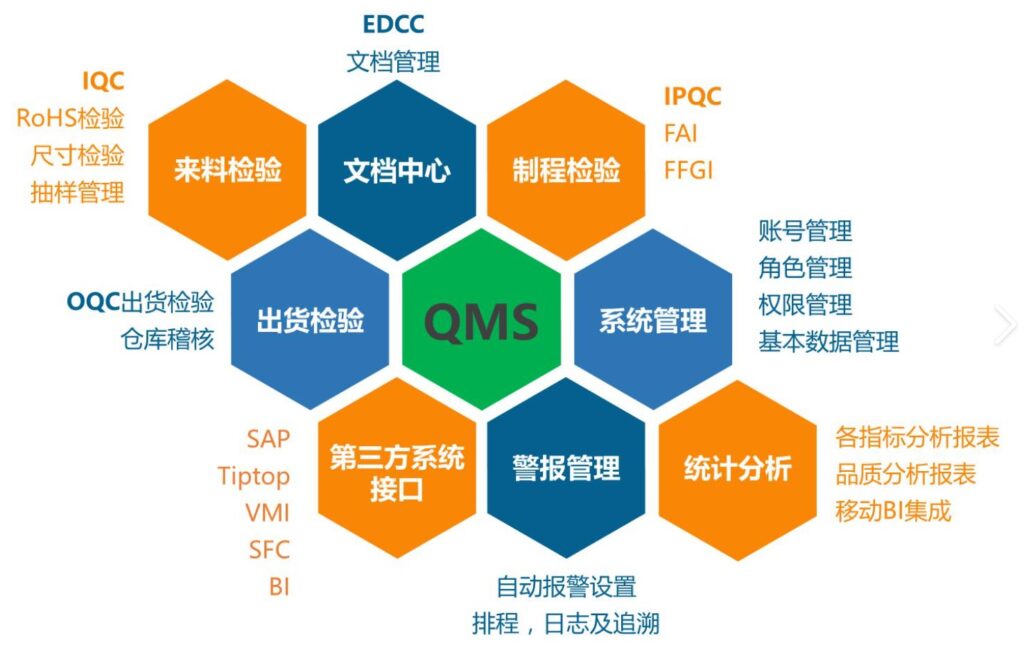
MSR的征求意见稿于2022年的2月发布,正式版本于2024年2月发布,2026年2月2日生效,制造商有两年的时间来调整内部流程和程序。美国FDA医疗器械质量体系法规俗称为QSR820。其中820是指的是美国联邦法规的第820章节。Q代表quality,S代表system,R代表regulation。美国FDA对QSR820质量体系进行修订,引进了国际标准化组织ISO13485-2016版本取代现有的大部分法规,更改后的质量体系新规叫做:QMSR(Quality Management System Regulation)
医疗质量检测技术及测试仪器展|质量管理体系构建中,值得避坑的案例学习!

近期国家药监局在对部分医疗器械企业进行飞检过程中,发现部分企业的质量管理体系存在较大缺陷,本次笔者就针对飞检的2家企业的问题进行收集整理,希望对各企业在质量管理体系的管理中有所借鉴和帮助。
医疗器械行业展览|减轻医疗器械供应链中的产品责任风险

当身处错综复杂的全球化时代,当网络支配着所有的商业脉搏,当患者因医疗器械产品组件故障而受伤,当不熟悉供应链中的所有环节,结果将令人望而生畏。
医疗器械制造展丨设计变更的质量管理实践

设计变更是一个关键的医疗器械质量管理体系中的环节,需要我们采取适当的步骤,确保变更的安全性、有效性以及符合法规要求。结合以往实战经验,提供以下是一些实施建议,期望可以帮助我们在设计变更活动中做得更好:
医疗器械制造展|详解FMEA分析方法
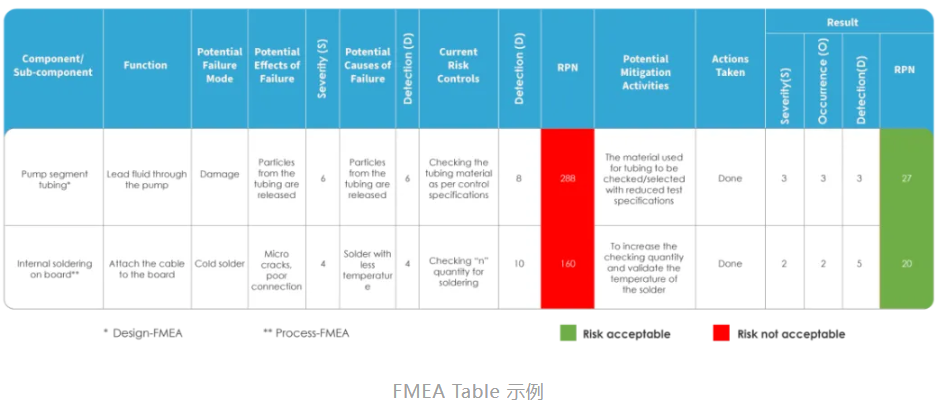
在医疗器械的开发过程中,确保产品的可靠性和安全性是至关重要的任务。为了实现这一目标,失效模式和影响分析(FMEA)成为了设计和风险管理的核心工具之一。FMEA 是一种系统的方法,通过识别和评估潜在的失效模式及其对系统、用户和环境的影响,帮助开发团队预防和减少产品故障。
医疗质量检测技术展|医疗器械生物相容性评价介绍

医疗器械生物相容性评价是一个复杂而细致的过程,它要求对医疗器械的各个方面进行全面考量。随着科技的发展和标准的完善,生物相容性评价将继续发展,以确保医疗器械的安全性和有效性,保护患者的健康。
上海医疗检测设备展|【专访】安徽英太自动化科技有限公司-总经理 马华伟先生

安徽英太自动化科技有限公司以全球检漏市场为导向,立足于气密检漏仪、气密检漏系统的研发、生产及销售并提供一站式的气密检漏解决方案。
医疗质量检测技术展 | 2024 年必投资的 6 大材料科学分析和制备仪器,你的实验室缺这个吗

前沿的实验室科学研究仪器和设备,不仅有助于加快科学研究的进程,也为未来的学术成果和企业的技术创新奠定了基础。一起跟随医疗质量检测技术展来看看 2024 年必投资的 6 大科学研究仪器,你错过了哪些?






