上海医疗检测设备展l 除菌过滤器的压力监测

《新版GMP附录1:无菌药品》中无菌药品的定义为:无菌药品是指法定药品标准中列有无菌检查项目的制剂和原料药,一般包括注射剂、无菌原料药、眼用制剂、无菌软膏剂、无菌混悬剂等。药品的无菌保证取决于合理且经过验证的灭菌工艺过程、良好的无菌保证体系以及生产过程中严格的GMP管理。
医疗质量检测技术展|ECA:关于欧盟无菌附录1的问答

是否有一个正式流程来确定附录1需要应用到API制造的范围?它在API制造期间如何被应用,以及如何系统地做出这些决定?
上海医疗检测设备展|医疗器械检测流程详解:哪些项目不可忽略?

医疗器械检测是确保产品安全性和有效性的关键步骤。无论是在开发阶段还是在产品上市前,医疗器械检测都扮演着至关重要的角色。企业需要通过一系列严格的检测环节,才能确保产品满足各项法规要求,顺利通过监管机构的审批,进入市场。
上海医疗测试仪器展|欧盟与我国GMP无菌药品附录差异分析

无菌药品作为高风险产品,其在生产管理和质量管理上具有其高标准和特殊性。
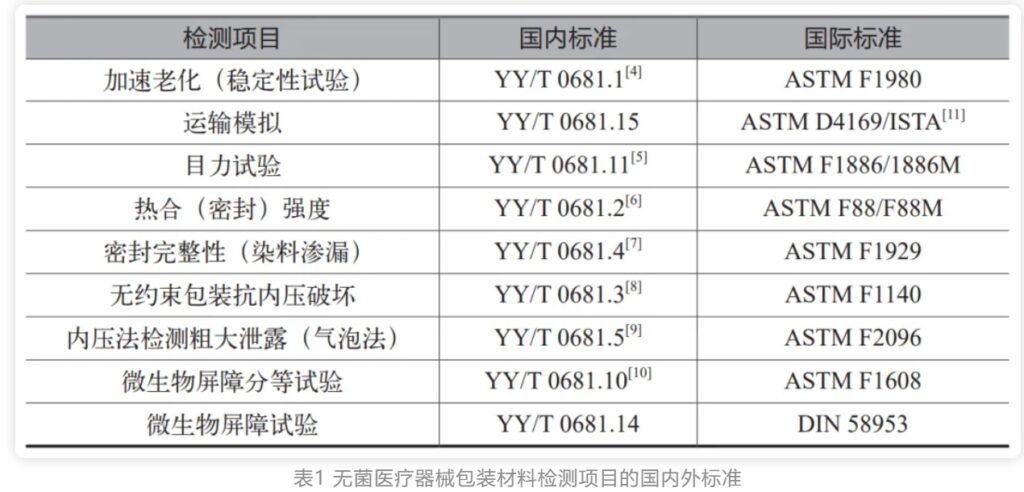
上海医疗检测设备展|无菌医疗器械包装质量控制要点(下)

无菌包装生产技术已经成熟。随着法规和检测技术的不断完善,使用企业对质量要求在逐步提高。法规和质量标准的推出将进一步规范无菌包装产品的质量和性能,从而更好地保障无菌医疗器械的安全性和有效性。
医疗质量检测技术展|无菌封管机验证指导

从缓冲液和培养基的准备、细胞培养操作、纯化操作到最终配方、过滤和转移,无菌断开是制造过程中的关键要素。
医疗质量检测技术展|有源医疗器械使用期限研究资料在注册过程的常见问题
部分申请人在选择直接评价路径时,未对器械的临床应用场景和使用状态进行详细分析,未根据器械结构特点和生产实际设计验证方案。如:低温储存设备、电动病床、洁净工作台等器械结构简单、体型较大,直接对设备整体进行加速试验需要配备大型的恒温恒湿老化试验箱,既增大了试验成本,也给企业自身带来负担,且这类器械主体结构为金属材质,在器械使用期限内较为稳定,不会因失效而产生使用风险。
医疗质量检测技术及测试仪器展|无菌医疗器械包装质量控制要点(上)
无菌医疗器械包装是保护医疗器械、预防感染的最后一道防线,包装失效会对病人和护士人员的健康和生命带来威胁。无菌医疗器械包装也称为无菌包装屏障系统,不同于食品行业的无菌包装。医疗器械无菌包装不仅需要有阻隔微生物的屏障能力,还要确保灭菌后能在一定期限内维持器械的无菌状态,并能够经受如环氧乙烷、伽马辐照、等离子过氧化氢、蒸汽等方式的灭菌。因此无菌医疗器械包装也被认为是医疗器械组成的一部分。
医疗质量检测技术展|医疗器械原材料变更的基本流程

医疗器械的预期用途、技术要求、安全有效性、有效期等等,很大程度上取决于原材料。
产品注册时确定下来的原材料,轻易不能变化。
但是,企业在实际经营过程中,常常为了降低成本、改善某方面性能、完善供应链、符合升版的标准,或主动、或被动地对原材料进行变更。
医疗质量检测技术及测试仪器展|医疗器械GMP:检验设备是否都需要校验

企业生产医疗器械时,为确认产品性能指标以及生产和检验环境的洁净度,需要对产品性能指标、洁净区环境、工艺用水、产品无菌性能、环氧乙烷残留量(EO灭菌)等进行检验。质量检验的结果是否准确可靠,取决于检验设备测量的结果的准确性,企业在使用检验设备时,需要提供客观证据,证明设备符合要求。






