医疗质量检测技术展|收藏!质量体系增加9001后,质量手册调整内容

医疗器械生产监管要求企业建立适应的质量体系以确保产品生产质量可控,但很多企业建立时仅纳入了GMP和13485,后续在做三方认证时意识到了9001的需求,故在原有体系上进行增加9001,这里就质量手册的改动部分做分享
医疗质量检测技术及测试仪器展|洁净室验证管理规范

本规范基于《医药工业洁净厂房设计规范》,进一步细化了医疗器械生产洁净室的验证管理要求,特别是设计计划(DQ)、安装验证(IQ)、运行验证(OQ)和性能验证(PQ)四个关键阶段,以确保洁净室的设计、建设、运行均符合GMP及国家相关标准,保障医疗器械的生产质量和安全性。
医疗质量检测技术及测试仪器展|无菌医疗器械包装质量控制要点(上)
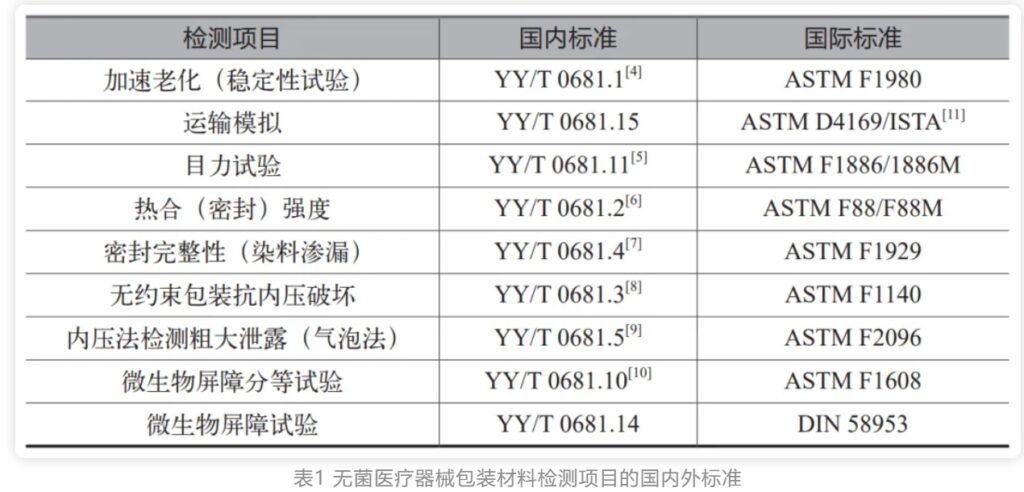
无菌医疗器械包装是保护医疗器械、预防感染的最后一道防线,包装失效会对病人和护士人员的健康和生命带来威胁。无菌医疗器械包装也称为无菌包装屏障系统,不同于食品行业的无菌包装。医疗器械无菌包装不仅需要有阻隔微生物的屏障能力,还要确保灭菌后能在一定期限内维持器械的无菌状态,并能够经受如环氧乙烷、伽马辐照、等离子过氧化氢、蒸汽等方式的灭菌。因此无菌医疗器械包装也被认为是医疗器械组成的一部分。
医疗质量检测技术展|医疗器械软件注册检验要点及方法研究
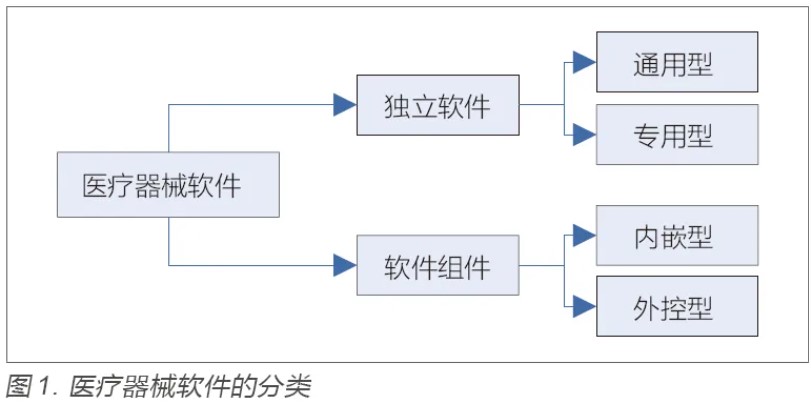
目的:针对医疗器械软件注册检验要点和检测方法进行研究,为加强医疗器械软件的质量保证工作提供参考。方法:以医疗器械软件注册指导原则为基础,梳理不同医疗器械软件的特点和分类,明确软件产品技术要求的编制指南,并且结合通用要求、质量要求、专用要求、安全要求四个方面的要求,对注册检验内容进行解读,最后总结常用检测方法和检测工具。结果:梳理的医疗器械软件注册检验要点可以为注册申请人编写产品技术要求提供指导,总结的检验方法和检测工具可以给检测机构开展相关评测提供借鉴。结论:医疗器械软件检验应从通用要求、质量要求、专用要求和安全要求四个方面进行,检测主要涉及功能测试和性能测试两大类,性能测试通常需借助专业工具进行。
医疗质量检测技术及测试仪器展|仪器校准标签有哪些常见错误?检查这几点就可以了

仪器校准以后,在仪器校准机构出具完校准证书以后,就会在所校准的仪器上贴上校准标签,校准标签上会有此次校准相关的信息,这些信息是提供给设备管理人员溯源以及巡查的参考,以方便相关人员 陈知道仪器上一次具体的校准情况信息,那么仪器校准标签有哪些常见错误?检查这几点就可以了。
医疗质量检测技术展|一文读懂我国医疗器械唯一标识UDI!

对于普通消费者而言,越来越多的人开始发现UDI的存在却并不了解其意义。但对于医疗器械从业者而言,UDI早已进入视野多年,UDI不仅仅只是一个专有名词,更是一个对生命健康有效监管的预警保障,也是从业者需要积极认识并应用实施的必备工具。
医疗质量检测技术及测试仪器展|设计技术考量点
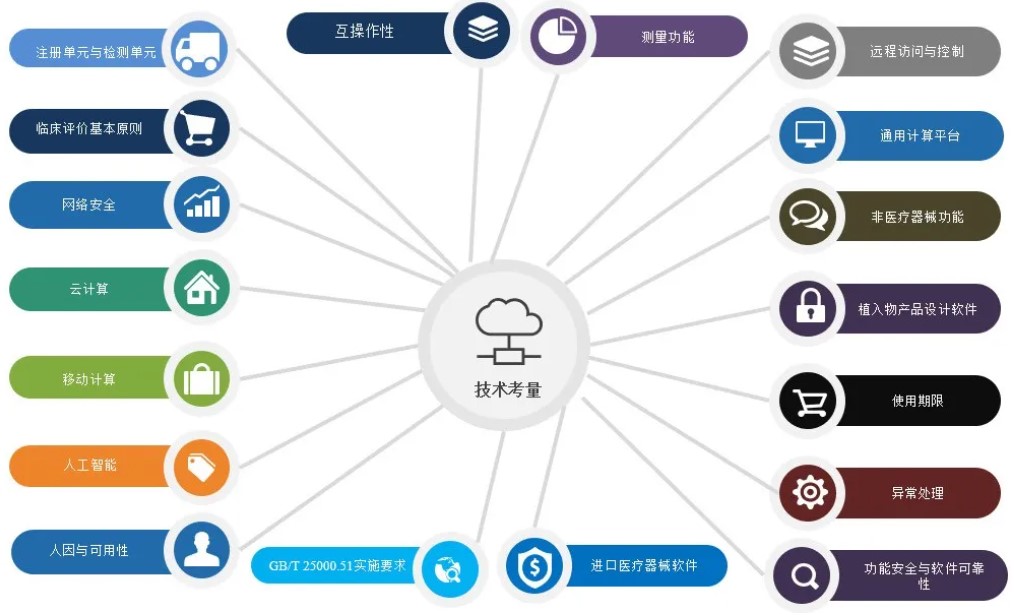
在进行医疗期器械软件设计过程中,我们可以从以下18点来进行技术考量。分别为1.注册单元与检测单元、2.临床评价基本原则、3.网络安全、4.云计算、5.移动计算、6.人工智能、7.人因与可用性、8.互操作性、9.测量功能、10.远程访问与控制、11.通用计算平台、12.非医疗器械功能、13.植入产品设计软件、14.使用期限、15.异常处理、16.功能安全与软件可靠性、17.GB/T25000.51实施要求和18.进口医疗器械软件等要求。
医疗质量检测技术展|医疗器械注册检验常见问题答疑汇总

A:维氏硬度检测不需要提供单独的试样,在送检样品上取样测试;洛氏硬度检测若被测部位形状不规则时,无法直接对样品进行测试,应提供原材料试样块,并提供材质、热处理工艺一致性声明。
上海医疗测试仪器展|医疗器械同品种临床评价报告怎么写?
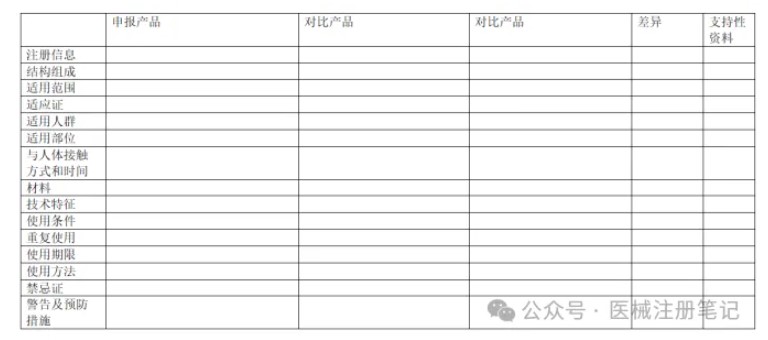
同品种比对是医疗器械注册申报过程中进行临床评价的重要方式之一,包括通过等同器械的临床数据进行临床评价以及使用可比器械的临床数据进行部分临床评价。同品种比对是企业节省大量研发费用,缩短新产品上市时间的优先选择。
医疗质量检测技术展|医疗器械注册质量管理体系核查指南介绍

本指南旨在加强医疗器械注册质量管理体系的核查管理,确保核查工作的质量。依据包括《医疗器械监督管理条例》、《医疗器械注册与备案管理办法》、《体外诊断试剂注册与备案管理办法》、《医疗器械生产监督管理办法》、《医疗器械生产质量管理规范》、《医疗器械临床试验质量管理规范》及《医疗器械注册自检管理规定》等法规。






