医疗质量检测技术及测试仪器展|仪器校准标签有哪些常见错误?检查这几点就可以了

仪器校准以后,在仪器校准机构出具完校准证书以后,就会在所校准的仪器上贴上校准标签,校准标签上会有此次校准相关的信息,这些信息是提供给设备管理人员溯源以及巡查的参考,以方便相关人员 陈知道仪器上一次具体的校准情况信息,那么仪器校准标签有哪些常见错误?检查这几点就可以了。
医疗质量检测技术及测试仪器展|设计技术考量点
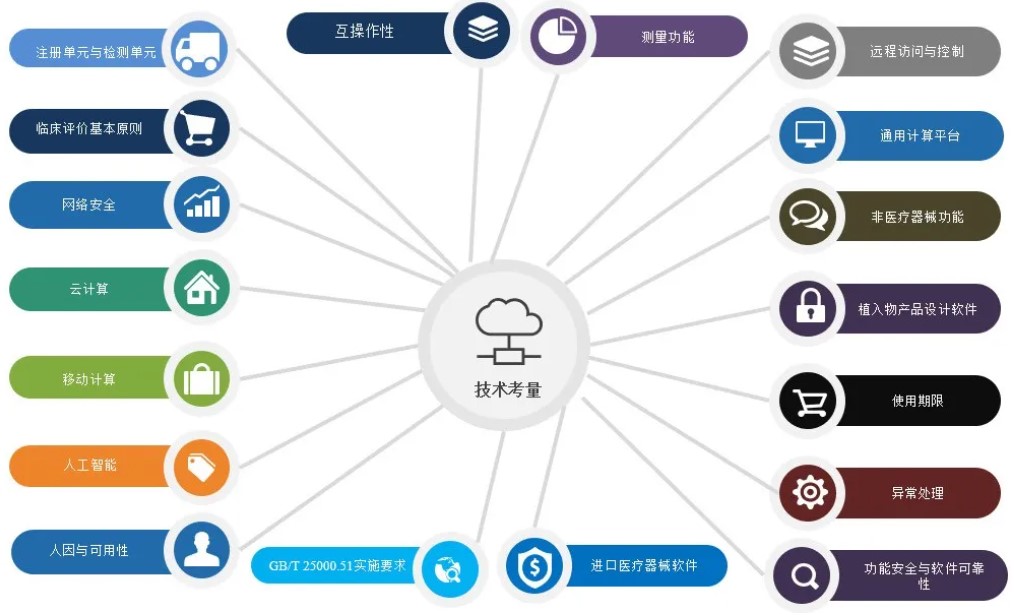
在进行医疗期器械软件设计过程中,我们可以从以下18点来进行技术考量。分别为1.注册单元与检测单元、2.临床评价基本原则、3.网络安全、4.云计算、5.移动计算、6.人工智能、7.人因与可用性、8.互操作性、9.测量功能、10.远程访问与控制、11.通用计算平台、12.非医疗器械功能、13.植入产品设计软件、14.使用期限、15.异常处理、16.功能安全与软件可靠性、17.GB/T25000.51实施要求和18.进口医疗器械软件等要求。
上海医疗测试仪器展|同品种医疗器械资料是否需要获取授权?
对于拟使用的同品种医疗器械非公开数据等需要提供授权,以保证数据来源的合法性;使用公开发表的数据,如公开发表的文献、数据、信息等,不需取得授权。数据如果来自公开数据、试验测量、行业共识等,不需取得授权。
医疗质量检测技术及测试仪器展|再谈MDR和FDA的器械可用性测试
测试完成后,您将需要制作一份可用性工程报告,该报告需要提交给您的医疗设备销售市场的相应监管机构。需要注意的是,这份报告不应该简单地总结你的可用性验证测试,而是需要一个非常具体的格式。
医疗质量检测技术及测试仪器展|医疗器械生物相容性简介、流程、路径和数据
医疗器械生物相容性评价是确保医疗器械安全性和有效性的重要环节,它涉及到对医疗器械在与人体接触时可能产生的生物学反应和风险的全面评估。根据国家标准GB/T 16886.1-2022《医疗器械生物学评价 第1部分:风险管理过程中的评价与试验》,生物相容性评价应作为医疗器械总体评价和开发过程的一部分,贯穿于产品的全生命周期。
医疗质量检测技术及测试仪器展|读懂GB9706医疗器械强制标准,离不开这5大问题!

GB9706.1-2020《医用电气设备 第1部分:基本安全和基本性能的通用要求》已经从2023年5月1日起开始实施。那么,企业在执行GB9706系列标准时经常遇到哪些问题?久顺收集汇总不少企业相关询问,本期一并解答。
医疗质量检测技术及测试仪器展|医疗器械GMP:检验设备是否都需要校验

企业生产医疗器械时,为确认产品性能指标以及生产和检验环境的洁净度,需要对产品性能指标、洁净区环境、工艺用水、产品无菌性能、环氧乙烷残留量(EO灭菌)等进行检验。质量检验的结果是否准确可靠,取决于检验设备测量的结果的准确性,企业在使用检验设备时,需要提供客观证据,证明设备符合要求。
上海医疗测试仪器展|医疗器械同品种临床评价报告怎么写?
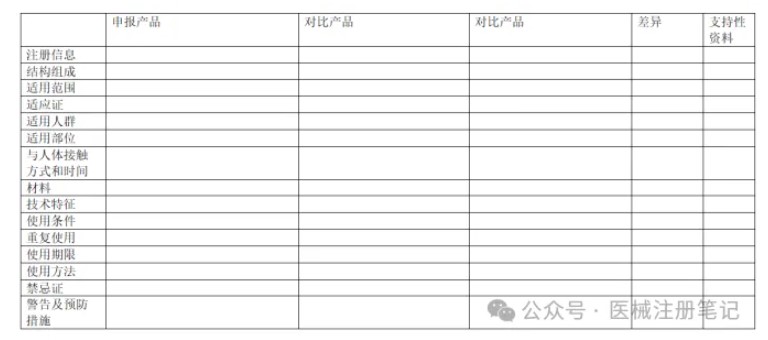
同品种比对是医疗器械注册申报过程中进行临床评价的重要方式之一,包括通过等同器械的临床数据进行临床评价以及使用可比器械的临床数据进行部分临床评价。同品种比对是企业节省大量研发费用,缩短新产品上市时间的优先选择。
医疗质量检测技术及测试仪器展|无源医疗器械安全性评价第二部分:货架有效期
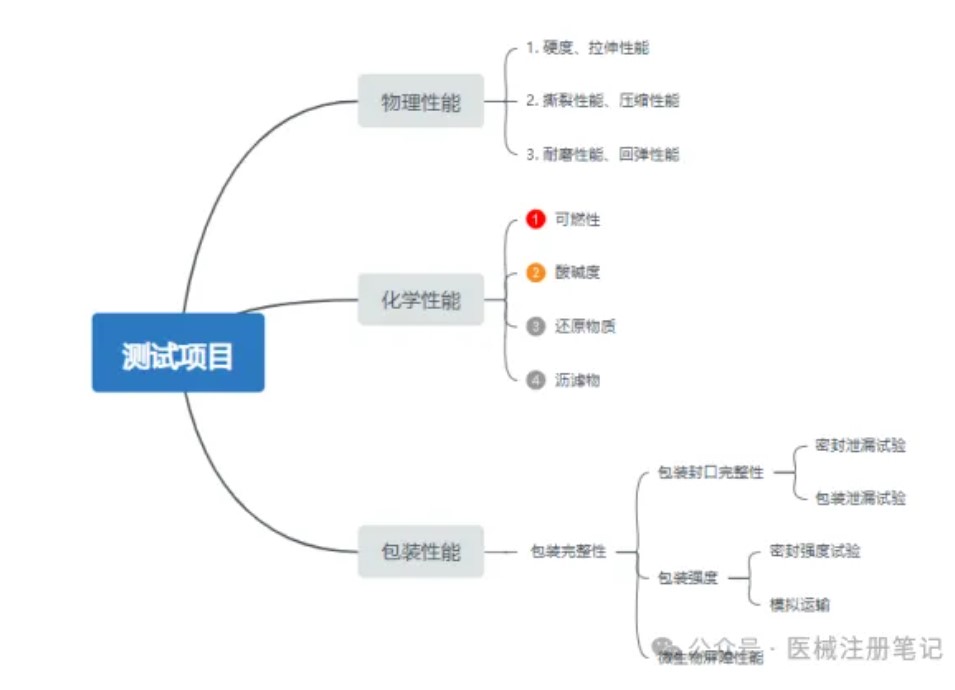
医疗器械注册阶段,货架有效期部分研究至关重要,货架有效期研究是确保产品在规定期限内能够正常发挥预期功能的重要证据。当医疗器械超过货架有效期研究规定的最大期限,器械的性能可能无法得到保证,在使用时则存在潜在风险。
上海医疗测试仪器展|ISO13485医疗器械质量管理标准 问与答 (一)

医疗器械质量管理体系起源于2000年我国发布的第22号医疗器械质量管理体系核查要求,并在此基础上历经九年发展形成了我国第一版医疗器械生产质量管理规范。随着医疗器械行业的快速发展,我国于2014年对GMP进行了修正并形成了最新的标准规范。同时,其他国家和地区也陆续建立了相应的质量管理体系标准法规,例如美国的CDMP及后续QSF20法规,欧盟的ENISO13485标准及其多次修订等。在70年代,美国率先制定了CDMP法规,并在其基础上于1996年发布针对质量管理体系要求的QSF20法规。欧盟则从1993年开始酝酿并报告了EN1N46001标准法规,但后来对该标准进行了修订和完善。国际标准化组织在1996年发布了基于ISO9001系列的两个医疗器械质量管理体系标准,即ISO13485:1996版与ISO13481:1996版,并随9001版本升级不断调整优化,最终在2016年发布了全新的ISO13485:2016版标准。






