技术资讯
实验室内的仪器数量一般都是比较多,在日常校准维护中,需要保持比较合理的周期,定期校准。然后说起仪器校准周期,很多也是老生常谈,常常说是根据仪器使用频繁程度,仪器磨损情况等来确定,但是具体要根据哪些规范做指导,实验室又能不能自己修改校准周期,很多人就不是很清楚。
仪器校准

实验室内的仪器数量一般都是比较多,在日常校准维护中,需要保持比较合理的周期,定期校准。然后说起仪器校准周期,很多也是老生常谈,常常说是根据仪器使用频繁程度,仪器磨损情况等来确定,但是具体要根据哪些规范做指导,实验室又能不能自己修改校准周期,很多人就不是很清楚。
仪器校准
这份法规文件主要规定了医疗器械在使用环节的质量管理要求和监督管理措施,旨在确保医疗器械的使用安全、有效。以下是文件中的关键知识点:
管理办法, 质量监督

这份法规文件主要规定了医疗器械在使用环节的质量管理要求和监督管理措施,旨在确保医疗器械的使用安全、有效。以下是文件中的关键知识点:
管理办法, 质量监督
对本条款的审核应围绕条款规定的要求进行,条款要求最高管理者指定一名管理层的成员为管代,“指定”需要具备客观的证据,因此要检查的是否有形成文件的管理者代表任命书。
条款解读

对本条款的审核应围绕条款规定的要求进行,条款要求最高管理者指定一名管理层的成员为管代,“指定”需要具备客观的证据,因此要检查的是否有形成文件的管理者代表任命书。
条款解读
随着计算机技术的进步,医疗器械软件行业正处于高速发展期。近年来,上海市独立软件产品申报数量大幅增长。相较于其他医疗器械产品,软件产品的多样化程度高、技术发展迅速、产品迭代更新快、非实体导致缺陷隐蔽性强,因此产品的安全有效性评价难度较高。在审评核查的过程中发现,医疗器械软件产品常见基本概念不清晰、性能指标和检验方法不明确、产品验证与确认不充分、生存周期过程控制不足等问题。标准在规范产品性能指标、保证产品安全有效性、促进创新和技术进步等方面发挥着重要的作用。随着医疗器械软件行业的迅速发展以及产品自身的复杂性,对配套标准也提出了更高的要求。本文在概要论述医疗器械软件标准发展现状的基础上,分析了目前在医疗器械独立软件审评核查中与标准相关的常见问题,探讨了如何更加有效地开展医疗器械软件质量评价工作,并提出了软件标准未来发展的若干思考和建议,以期加强标准的指导意义、统一评价尺度、促进医疗器械软件的标准化进程。
标准, 软件核查
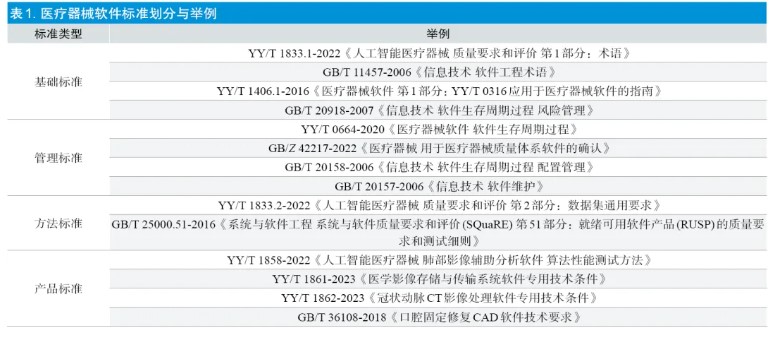
随着计算机技术的进步,医疗器械软件行业正处于高速发展期。近年来,上海市独立软件产品申报数量大幅增长。相较于其他医疗器械产品,软件产品的多样化程度高、技术发展迅速、产品迭代更新快、非实体导致缺陷隐蔽性强,因此产品的安全有效性评价难度较高。在审评核查的过程中发现,医疗器械软件产品常见基本概念不清晰、性能指标和检验方法不明确、产品验证与确认不充分、生存周期过程控制不足等问题。标准在规范产品性能指标、保证产品安全有效性、促进创新和技术进步等方面发挥着重要的作用。随着医疗器械软件行业的迅速发展以及产品自身的复杂性,对配套标准也提出了更高的要求。本文在概要论述医疗器械软件标准发展现状的基础上,分析了目前在医疗器械独立软件审评核查中与标准相关的常见问题,探讨了如何更加有效地开展医疗器械软件质量评价工作,并提出了软件标准未来发展的若干思考和建议,以期加强标准的指导意义、统一评价尺度、促进医疗器械软件的标准化进程。
标准, 软件核查

技术资讯
PART 830—唯一设备标识(UDI) 是美国食品药品监督管理局(FDA)制定的一个法规,旨在为医疗器械创建一个标准化的识别系统。
UDI
PART 830—唯一设备标识(UDI) 是美国食品药品监督管理局(FDA)制定的一个法规,旨在为医疗器械创建一个标准化的识别系统。
UDI


医疗机构对于仪器管理都比较重视,一般还会成立专门的品管部,每到一定时间就会对机构内的仪器进行检测维护,如果不及时进行仪器校准维护,更新相关的医疗仪器校准证书,相关部门的检查就很难通过,并且还会埋藏较大的安全隐患。那么医疗仪器校准证书有效期是怎样进行规定的?多久校准一次?医疗质量检测技术展为您进行详细介绍。
仪器校准
医疗机构对于仪器管理都比较重视,一般还会成立专门的品管部,每到一定时间就会对机构内的仪器进行检测维护,如果不及时进行仪器校准维护,更新相关的医疗仪器校准证书,相关部门的检查就很难通过,并且还会埋藏较大的安全隐患。那么医疗仪器校准证书有效期是怎样进行规定的?多久校准一次?医疗质量检测技术展为您进行详细介绍。
仪器校准
环氧乙烷灭菌在医疗器械灭菌领域具有不可替代的地位,尤其对于那些无法承受高温高压环境的精密器械以及一次性使用医疗器械而言,是确保其无菌性的关键工艺。然而,这一灭菌过程受到多种复杂因素的交互影响,任何一个环节的波动都可能导致灭菌效果偏离预期。
环氧乙烷灭菌

环氧乙烷灭菌在医疗器械灭菌领域具有不可替代的地位,尤其对于那些无法承受高温高压环境的精密器械以及一次性使用医疗器械而言,是确保其无菌性的关键工艺。然而,这一灭菌过程受到多种复杂因素的交互影响,任何一个环节的波动都可能导致灭菌效果偏离预期。
环氧乙烷灭菌






