技术资讯
在医疗器械行业,产品的安全性和合规性一直是至关重要的问题。在上海医疗测试仪器展上,这一点尤其受到关注。为了确保医疗器械在临床使用中能够安全可靠地发挥作用,医疗器械测试是必不可少的步骤。
安全合规, 测试项目清单

在医疗器械行业,产品的安全性和合规性一直是至关重要的问题。在上海医疗测试仪器展上,这一点尤其受到关注。为了确保医疗器械在临床使用中能够安全可靠地发挥作用,医疗器械测试是必不可少的步骤。
安全合规, 测试项目清单


磁兼容性(EMC)是衡量电子设备在电磁环境中正常工作且不对该环境中任何事物构成不能承受的电磁骚扰的能力。对于医疗器械而言,由于其直接应用于人体,对EMC的要求更为严格。
医疗器械EMC
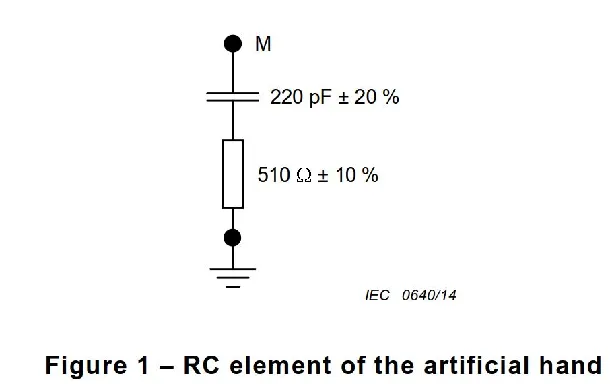
磁兼容性(EMC)是衡量电子设备在电磁环境中正常工作且不对该环境中任何事物构成不能承受的电磁骚扰的能力。对于医疗器械而言,由于其直接应用于人体,对EMC的要求更为严格。
医疗器械EMC
《新版GMP附录1:无菌药品》中无菌药品的定义为:无菌药品是指法定药品标准中列有无菌检查项目的制剂和原料药,一般包括注射剂、无菌原料药、眼用制剂、无菌软膏剂、无菌混悬剂等。药品的无菌保证取决于合理且经过验证的灭菌工艺过程、良好的无菌保证体系以及生产过程中严格的GMP管理。
压力监测, 无菌, 过滤器

《新版GMP附录1:无菌药品》中无菌药品的定义为:无菌药品是指法定药品标准中列有无菌检查项目的制剂和原料药,一般包括注射剂、无菌原料药、眼用制剂、无菌软膏剂、无菌混悬剂等。药品的无菌保证取决于合理且经过验证的灭菌工艺过程、良好的无菌保证体系以及生产过程中严格的GMP管理。
压力监测, 无菌, 过滤器
技术资讯
通过对工艺用水系统的全面验证,确保该系统能够连续稳定地供应满足生产需求的水量,并证明制水过程能够在长期内持续制备出符合《医疗器械生产质量管理规范-无菌医疗器械实施细则》要求的工艺用水。
用水验证

通过对工艺用水系统的全面验证,确保该系统能够连续稳定地供应满足生产需求的水量,并证明制水过程能够在长期内持续制备出符合《医疗器械生产质量管理规范-无菌医疗器械实施细则》要求的工艺用水。
用水验证
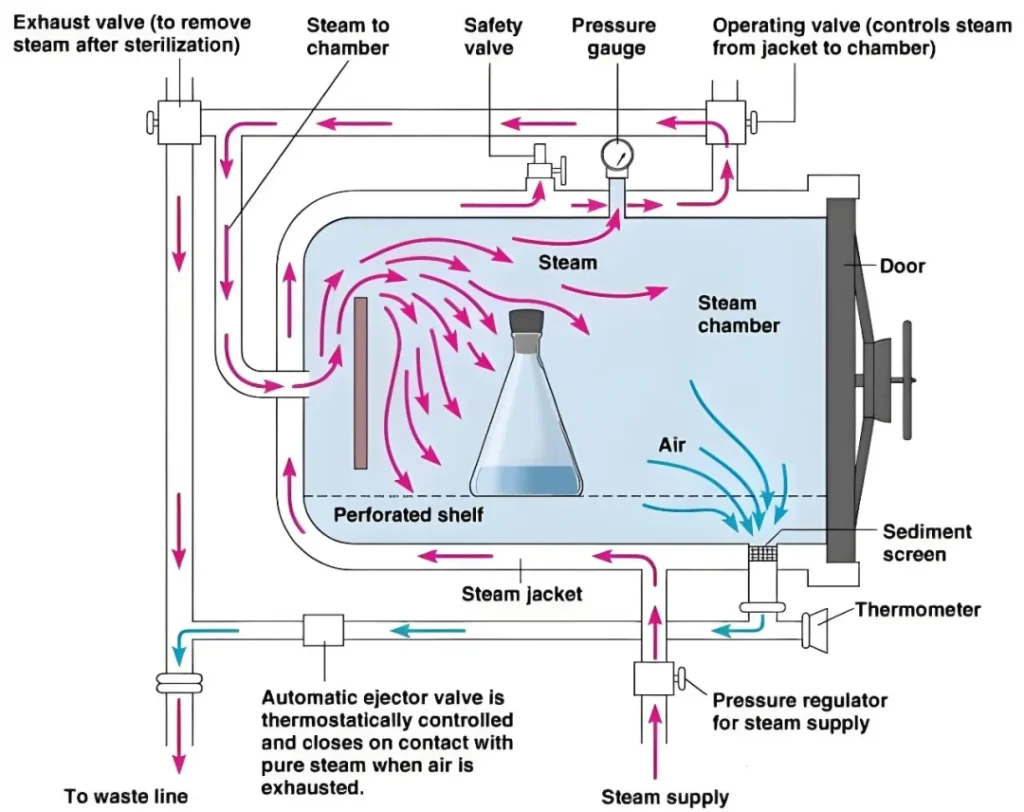
在医疗器械行业,验证(Verification)与确认(Validation)不仅仅是质量管理的基本要素,更是确保产品安全、有效性的关键步骤。在医疗质量检测技术及测试仪器展上,这些关键步骤得到了特别的关注和展示。
验证与确认
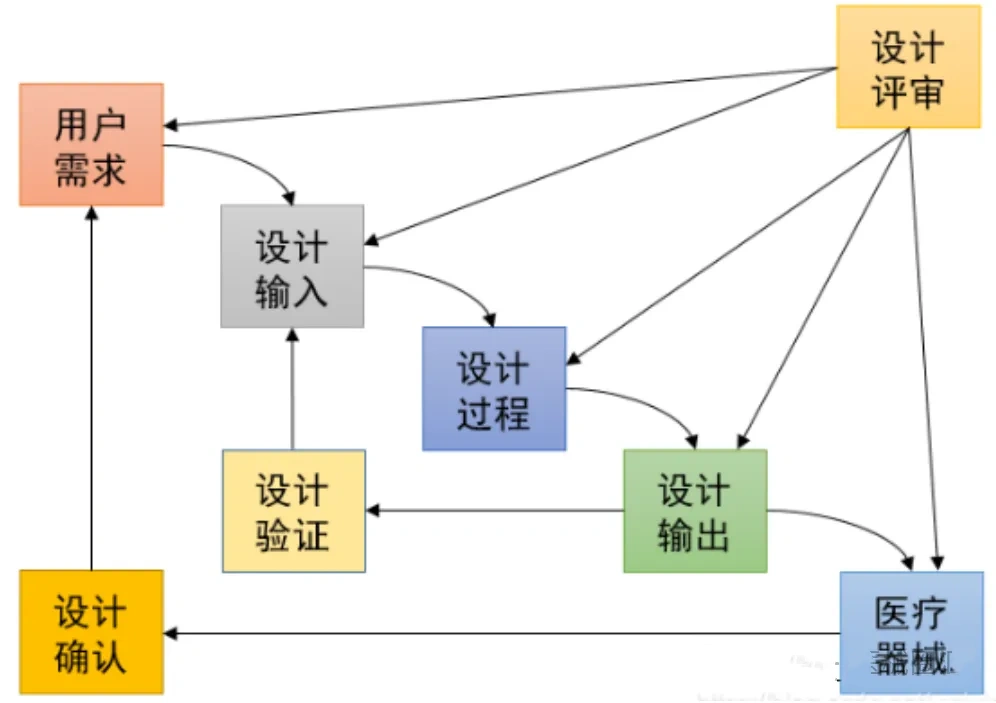
在医疗器械行业,验证(Verification)与确认(Validation)不仅仅是质量管理的基本要素,更是确保产品安全、有效性的关键步骤。在医疗质量检测技术及测试仪器展上,这些关键步骤得到了特别的关注和展示。
验证与确认
ISO13485:2016《医疗器械质量管理体系用于法规的要求》,由ISO国际标准化组织于2016年3月1 日正式发布,是一项应用于医疗器械领域的质量管理体系的国际标准,强调医疗器械的安全有效,组织提供的医疗器械要满足顾客和法规要求。
ISO13485和GB/T42061, 输入
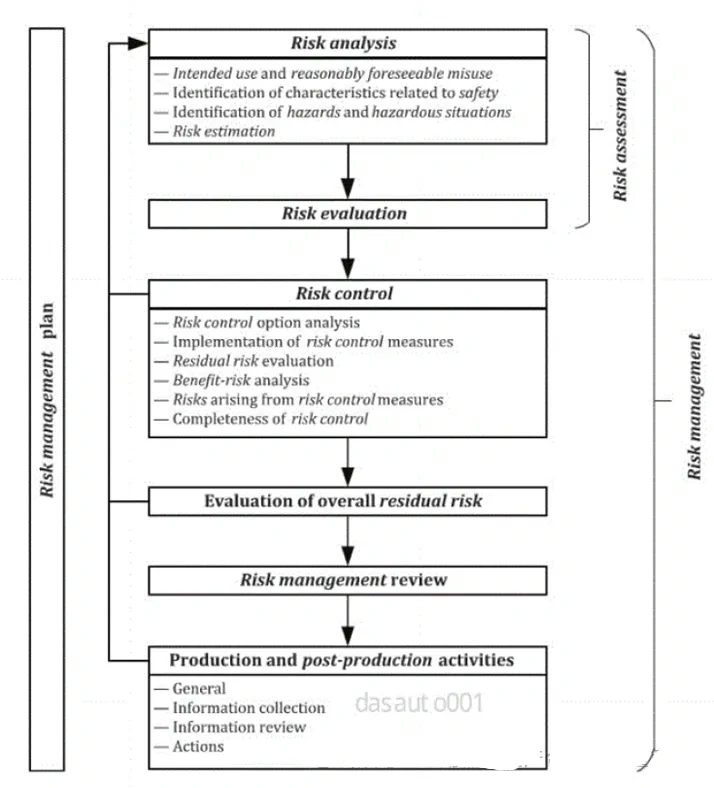
ISO13485:2016《医疗器械质量管理体系用于法规的要求》,由ISO国际标准化组织于2016年3月1 日正式发布,是一项应用于医疗器械领域的质量管理体系的国际标准,强调医疗器械的安全有效,组织提供的医疗器械要满足顾客和法规要求。
ISO13485和GB/T42061, 输入
生产企业应当按照医疗器械生产质量管理规范的要求,结合产品特点,建立健全与所生产医疗器械相适应的质量管理体系,并保证其有效运行。在医疗质量检测技术展上,这些生产企业将有机会展示他们如何遵循这些规范,并通过先进的质量管理系统确保其产品的高标准和可靠性。
GMP, 生产质量管理
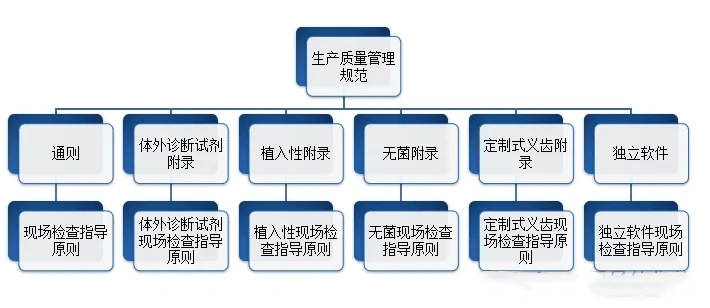
生产企业应当按照医疗器械生产质量管理规范的要求,结合产品特点,建立健全与所生产医疗器械相适应的质量管理体系,并保证其有效运行。在医疗质量检测技术展上,这些生产企业将有机会展示他们如何遵循这些规范,并通过先进的质量管理系统确保其产品的高标准和可靠性。
GMP, 生产质量管理






