技术资讯
无菌医疗器械包装是保护医疗器械、预防感染的最后一道防线,包装失效会对病人和护士人员的健康和生命带来威胁。无菌医疗器械包装也称为无菌包装屏障系统,不同于食品行业的无菌包装。医疗器械无菌包装不仅需要有阻隔微生物的屏障能力,还要确保灭菌后能在一定期限内维持器械的无菌状态,并能够经受如环氧乙烷、伽马辐照、等离子过氧化氢、蒸汽等方式的灭菌。因此无菌医疗器械包装也被认为是医疗器械组成的一部分。
包装, 无菌, 质量控制
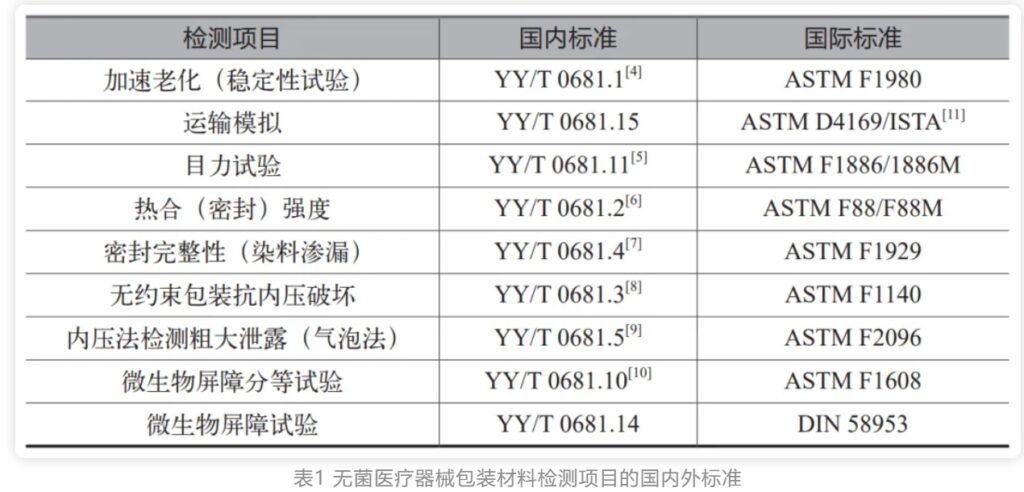
无菌医疗器械包装是保护医疗器械、预防感染的最后一道防线,包装失效会对病人和护士人员的健康和生命带来威胁。无菌医疗器械包装也称为无菌包装屏障系统,不同于食品行业的无菌包装。医疗器械无菌包装不仅需要有阻隔微生物的屏障能力,还要确保灭菌后能在一定期限内维持器械的无菌状态,并能够经受如环氧乙烷、伽马辐照、等离子过氧化氢、蒸汽等方式的灭菌。因此无菌医疗器械包装也被认为是医疗器械组成的一部分。
包装, 无菌, 质量控制
本文件规定了符合YY/T 0698.2、0698.3、0698.6、0698.7、0698.9或 0698.10透气材料和符合本文件第4章规定的塑料膜组成的可密封组合袋和卷材的要求和试验方法。这些可密封组合袋和卷材可用作无菌屏障系统和/或包装系统,以保证最终灭菌医疗器械到使用时的无菌性。
灭菌, 试验要求
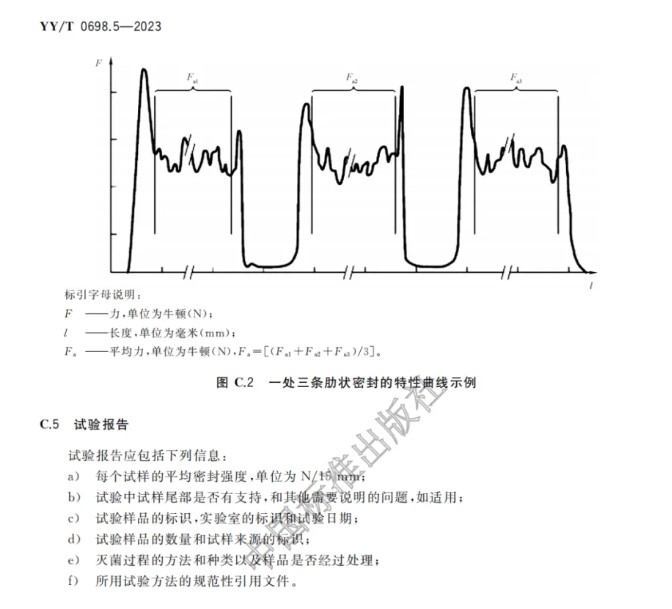
本文件规定了符合YY/T 0698.2、0698.3、0698.6、0698.7、0698.9或 0698.10透气材料和符合本文件第4章规定的塑料膜组成的可密封组合袋和卷材的要求和试验方法。这些可密封组合袋和卷材可用作无菌屏障系统和/或包装系统,以保证最终灭菌医疗器械到使用时的无菌性。
灭菌, 试验要求
目的:针对医疗器械软件注册检验要点和检测方法进行研究,为加强医疗器械软件的质量保证工作提供参考。方法:以医疗器械软件注册指导原则为基础,梳理不同医疗器械软件的特点和分类,明确软件产品技术要求的编制指南,并且结合通用要求、质量要求、专用要求、安全要求四个方面的要求,对注册检验内容进行解读,最后总结常用检测方法和检测工具。结果:梳理的医疗器械软件注册检验要点可以为注册申请人编写产品技术要求提供指导,总结的检验方法和检测工具可以给检测机构开展相关评测提供借鉴。结论:医疗器械软件检验应从通用要求、质量要求、专用要求和安全要求四个方面进行,检测主要涉及功能测试和性能测试两大类,性能测试通常需借助专业工具进行。
检验, 注册
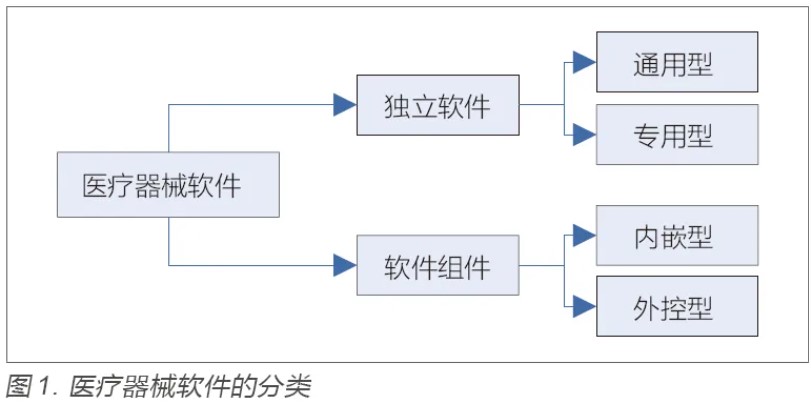
目的:针对医疗器械软件注册检验要点和检测方法进行研究,为加强医疗器械软件的质量保证工作提供参考。方法:以医疗器械软件注册指导原则为基础,梳理不同医疗器械软件的特点和分类,明确软件产品技术要求的编制指南,并且结合通用要求、质量要求、专用要求、安全要求四个方面的要求,对注册检验内容进行解读,最后总结常用检测方法和检测工具。结果:梳理的医疗器械软件注册检验要点可以为注册申请人编写产品技术要求提供指导,总结的检验方法和检测工具可以给检测机构开展相关评测提供借鉴。结论:医疗器械软件检验应从通用要求、质量要求、专用要求和安全要求四个方面进行,检测主要涉及功能测试和性能测试两大类,性能测试通常需借助专业工具进行。
检验, 注册
无菌类器械510(k)中,成熟的灭菌方法包括蒸汽灭菌、干热灭菌、环氧乙烷(EO)灭菌、辐射灭菌、汽化过氧化氢、臭氧等。正在开发的全新灭菌技术并将用于I类和II类器械生产的,被视为新方法。对于采用新灭菌技术灭菌的器械,如果操作不当,会带来灭菌不到位的重大风险。因此,应密切评估使用这些技术灭菌的器械是否符合GMP。FDA计划先审查其制造机构再授予510(k)许可,这将有助于确保器械的安全性和有效性,并降低对人类健康的风险。
FDA,无菌,灭菌

无菌类器械510(k)中,成熟的灭菌方法包括蒸汽灭菌、干热灭菌、环氧乙烷(EO)灭菌、辐射灭菌、汽化过氧化氢、臭氧等。正在开发的全新灭菌技术并将用于I类和II类器械生产的,被视为新方法。对于采用新灭菌技术灭菌的器械,如果操作不当,会带来灭菌不到位的重大风险。因此,应密切评估使用这些技术灭菌的器械是否符合GMP。FDA计划先审查其制造机构再授予510(k)许可,这将有助于确保器械的安全性和有效性,并降低对人类健康的风险。
FDA,无菌,灭菌
为确保研发试验数据的准确可靠,研发使用的仪器、仪表需要进行计量/校准/校验。不同的仪器、仪表计量/校准/校验的要求是有所不同的。按仪器、仪表精度和故障对数据或产品的影响程度,分为:关键仪器、重要仪器/仪表和一般量具。
仪器, 仪表, 校准, 校验, 管理
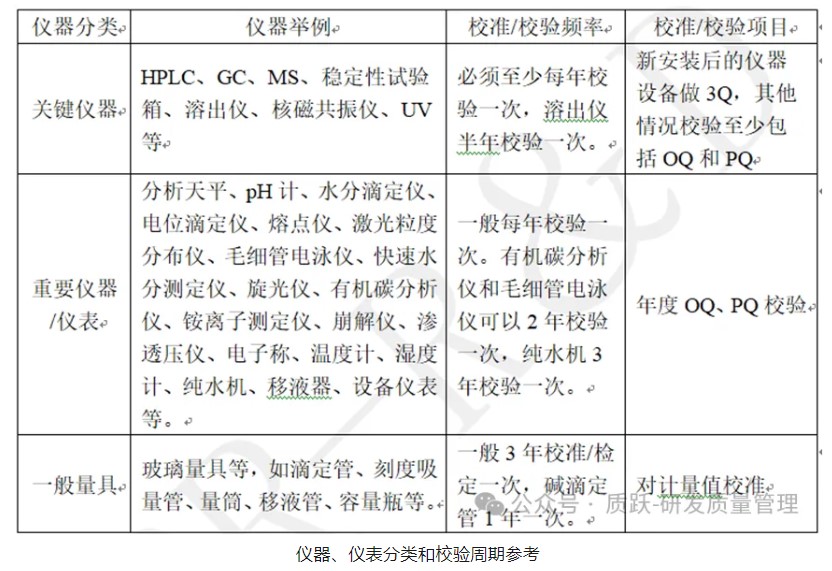
为确保研发试验数据的准确可靠,研发使用的仪器、仪表需要进行计量/校准/校验。不同的仪器、仪表计量/校准/校验的要求是有所不同的。按仪器、仪表精度和故障对数据或产品的影响程度,分为:关键仪器、重要仪器/仪表和一般量具。
仪器, 仪表, 校准, 校验, 管理
技术资讯
通过对工艺用水系统的全面验证,确保该系统能够连续稳定地供应满足生产需求的水量,并证明制水过程能够在长期内持续制备出符合《医疗器械生产质量管理规范-无菌医疗器械实施细则》要求的工艺用水。
用水验证

通过对工艺用水系统的全面验证,确保该系统能够连续稳定地供应满足生产需求的水量,并证明制水过程能够在长期内持续制备出符合《医疗器械生产质量管理规范-无菌医疗器械实施细则》要求的工艺用水。
用水验证
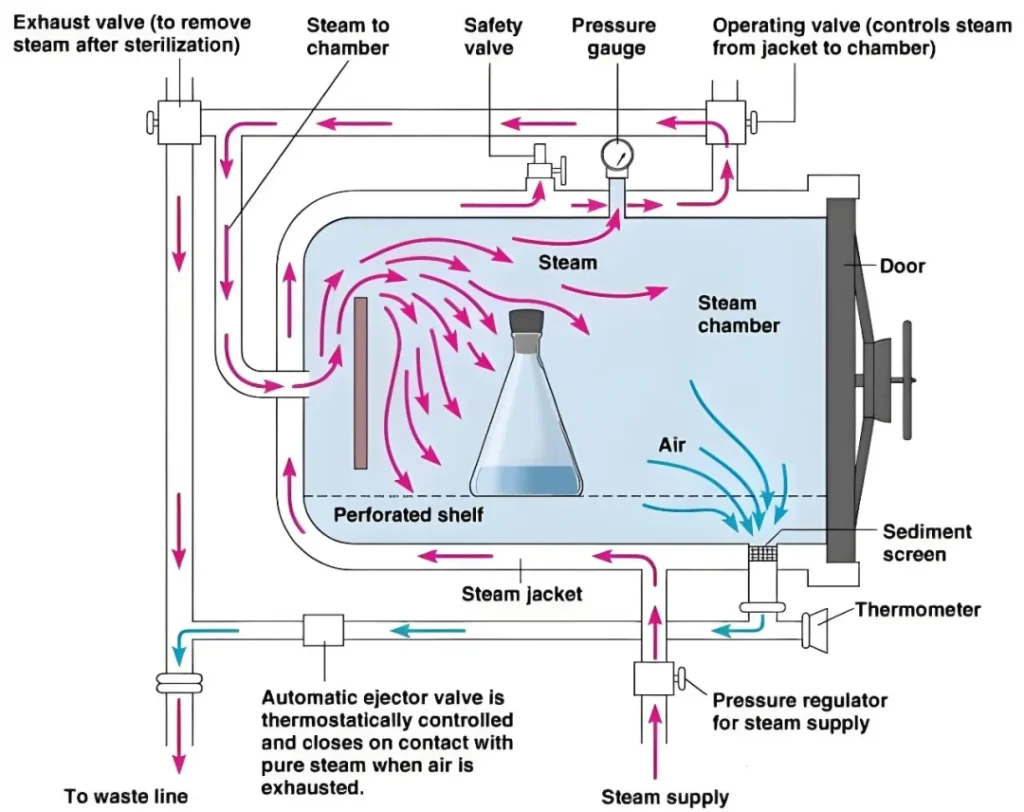
在医疗器械行业,验证(Verification)与确认(Validation)不仅仅是质量管理的基本要素,更是确保产品安全、有效性的关键步骤。在医疗质量检测技术及测试仪器展上,这些关键步骤得到了特别的关注和展示。
验证与确认
在医疗器械行业,验证(Verification)与确认(Validation)不仅仅是质量管理的基本要素,更是确保产品安全、有效性的关键步骤。在医疗质量检测技术及测试仪器展上,这些关键步骤得到了特别的关注和展示。
验证与确认
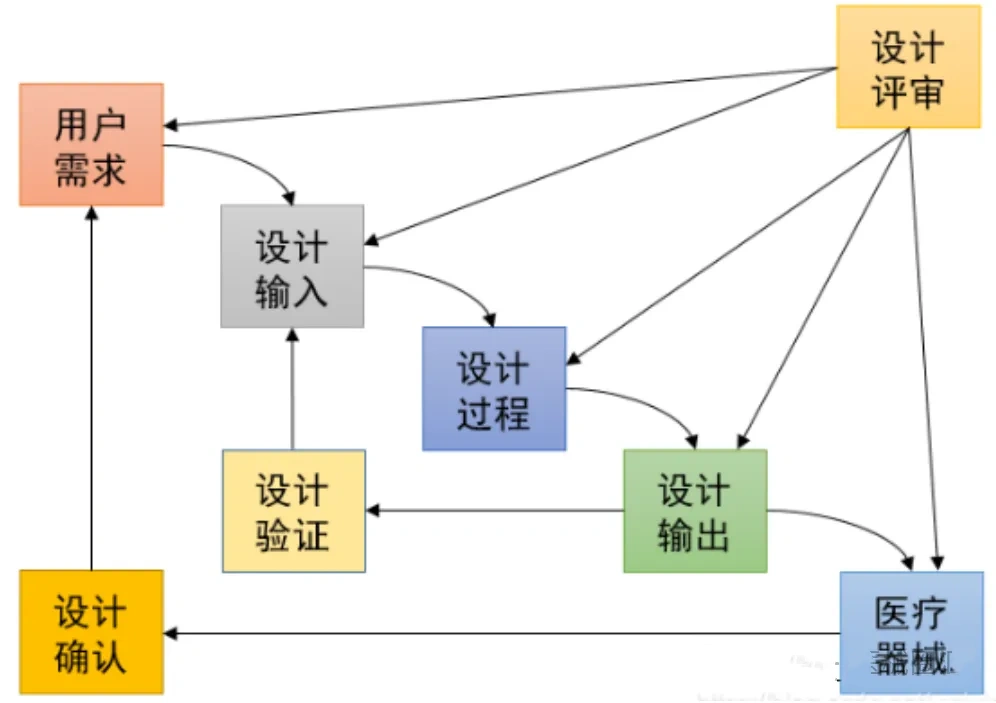
ISO13485:2016《医疗器械质量管理体系用于法规的要求》,由ISO国际标准化组织于2016年3月1 日正式发布,是一项应用于医疗器械领域的质量管理体系的国际标准,强调医疗器械的安全有效,组织提供的医疗器械要满足顾客和法规要求。
ISO13485和GB/T42061, 输入
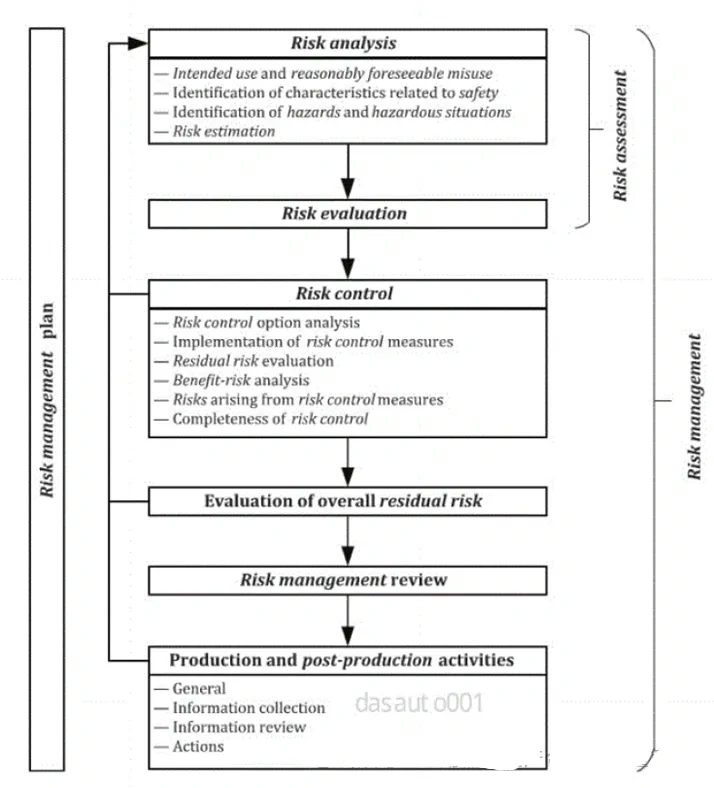
ISO13485:2016《医疗器械质量管理体系用于法规的要求》,由ISO国际标准化组织于2016年3月1 日正式发布,是一项应用于医疗器械领域的质量管理体系的国际标准,强调医疗器械的安全有效,组织提供的医疗器械要满足顾客和法规要求。
ISO13485和GB/T42061, 输入
生产企业应当按照医疗器械生产质量管理规范的要求,结合产品特点,建立健全与所生产医疗器械相适应的质量管理体系,并保证其有效运行。在医疗质量检测技术展上,这些生产企业将有机会展示他们如何遵循这些规范,并通过先进的质量管理系统确保其产品的高标准和可靠性。
GMP, 生产质量管理
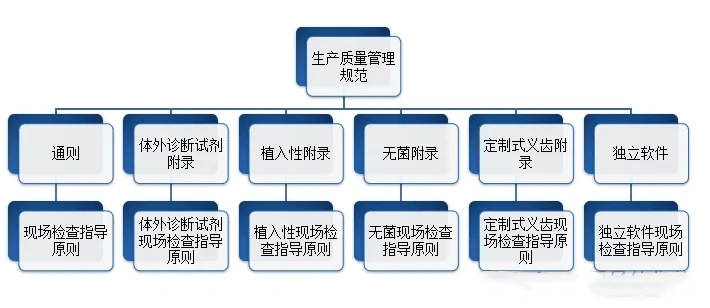
生产企业应当按照医疗器械生产质量管理规范的要求,结合产品特点,建立健全与所生产医疗器械相适应的质量管理体系,并保证其有效运行。在医疗质量检测技术展上,这些生产企业将有机会展示他们如何遵循这些规范,并通过先进的质量管理系统确保其产品的高标准和可靠性。
GMP, 生产质量管理






