技术资讯
- 2024-08-07
近期国家药监局在对部分医疗器械企业进行飞检过程中,发现部分企业的质量管理体系存在较大缺陷,本次笔者就针对飞检的2家企业的问题进行收集整理,希望对各企业在质量管理体系的管理中有所借鉴和帮助。
案例, 质量管理, 飞行检查

近期国家药监局在对部分医疗器械企业进行飞检过程中,发现部分企业的质量管理体系存在较大缺陷,本次笔者就针对飞检的2家企业的问题进行收集整理,希望对各企业在质量管理体系的管理中有所借鉴和帮助。
案例, 质量管理, 飞行检查

- 2024-08-06
DQE是在产品设计和开发过程中负责质量管理和质量保证的专业人员。他们的主要职责是确保产品设计符合质量标准和客户要求。以下是DQE设计质量工程师的常见工作职责:
1. 质量计划和策略:制定和执行产品设计和开发阶段的质量计划和策略,确保产品符合质量标准和规范。
岗位职责, 质量管理
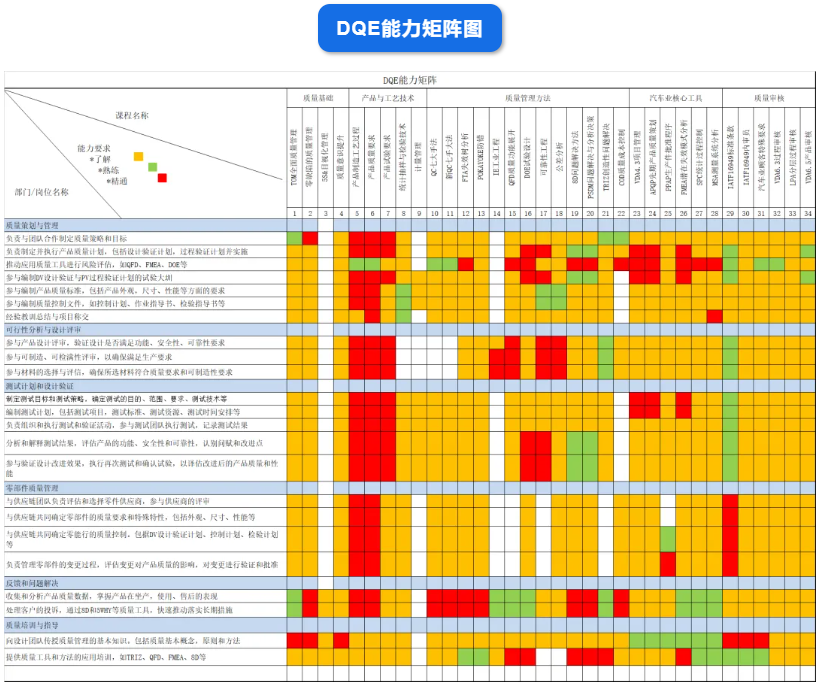
DQE是在产品设计和开发过程中负责质量管理和质量保证的专业人员。他们的主要职责是确保产品设计符合质量标准和客户要求。以下是DQE设计质量工程师的常见工作职责:
1. 质量计划和策略:制定和执行产品设计和开发阶段的质量计划和策略,确保产品符合质量标准和规范。
岗位职责, 质量管理
- 2024-08-06
焦距是光学系统的一个非常重要的指标,对于焦距的概念,大家或多或少都有了解,我们这里再回顾一下。
光学系统的焦距,定义为平行光入射时从光学系统的光学中心到光束聚焦点的距离,是衡量光学系统中光的聚集或发散的度量方式。我们用下面的图来说明这一概念。
光学, 测试, 质量管理
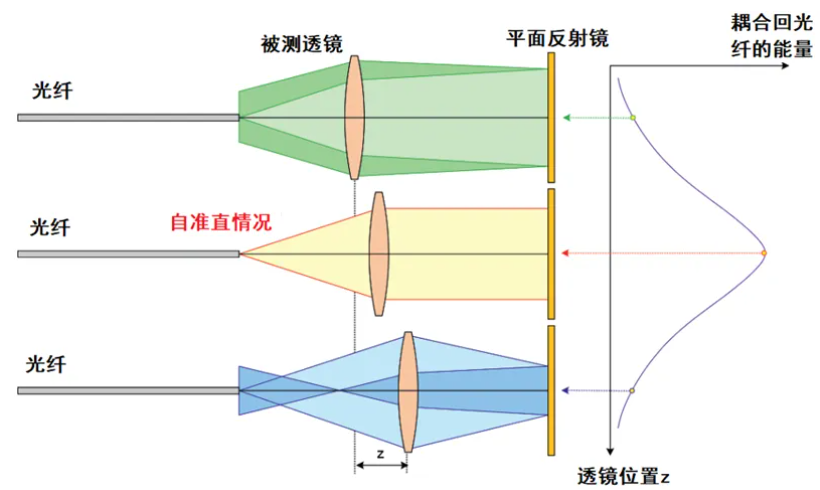
焦距是光学系统的一个非常重要的指标,对于焦距的概念,大家或多或少都有了解,我们这里再回顾一下。
光学系统的焦距,定义为平行光入射时从光学系统的光学中心到光束聚焦点的距离,是衡量光学系统中光的聚集或发散的度量方式。我们用下面的图来说明这一概念。
光学, 测试, 质量管理
技术资讯
- 2024-10-23
众所周知,工厂生产工业品,都要经过检验合格之后才能上市销售。特别是食品、药品、医疗器械等与人们健康息息相关的产品,检验标准尤为严格。国家药监局2019年8月发布了《国家药监局关于印发医疗器械检验工作规范的通知》,进一步规范医疗器械检验工作。
检测报告

众所周知,工厂生产工业品,都要经过检验合格之后才能上市销售。特别是食品、药品、医疗器械等与人们健康息息相关的产品,检验标准尤为严格。国家药监局2019年8月发布了《国家药监局关于印发医疗器械检验工作规范的通知》,进一步规范医疗器械检验工作。
检测报告

检测, 流程
- 2024-10-22
在用医疗器械质量检测的常见方法多种多样,这些方法旨在确保医疗器械的安全性、有效性和符合相关标准。
常见方法, 质量检测

- 2024-10-22
医疗器械检测是确保产品安全性和有效性的关键步骤。无论是在开发阶段还是在产品上市前,医疗器械检测都扮演着至关重要的角色。企业需要通过一系列严格的检测环节,才能确保产品满足各项法规要求,顺利通过监管机构的审批,进入市场。
检测流程

医疗器械检测是确保产品安全性和有效性的关键步骤。无论是在开发阶段还是在产品上市前,医疗器械检测都扮演着至关重要的角色。企业需要通过一系列严格的检测环节,才能确保产品满足各项法规要求,顺利通过监管机构的审批,进入市场。
检测流程







