技术资讯
- 2024-09-02
人工智能算法的类型不同,其算法特性、适用场景也不同,评价重点亦有所侧重;同时,不同类型的人工智能算法可组合使用,需结合各算法特性和算法组合形式进行整体评价。
注册审查
人工智能算法的类型不同,其算法特性、适用场景也不同,评价重点亦有所侧重;同时,不同类型的人工智能算法可组合使用,需结合各算法特性和算法组合形式进行整体评价。
注册审查
- 2024-09-02
医疗器械网络安全更新从内容上可分为功能更新、补丁更新,类似于增强类软件更新、纠正类软件更新。
根据其对医疗器械安全性和有效性的影响程度分为以下两类:
网络安全
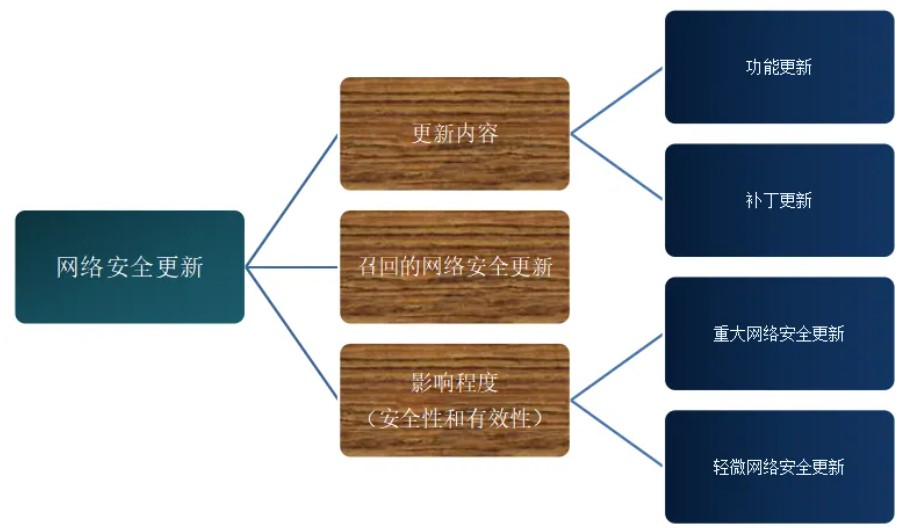
医疗器械网络安全更新从内容上可分为功能更新、补丁更新,类似于增强类软件更新、纠正类软件更新。
根据其对医疗器械安全性和有效性的影响程度分为以下两类:
网络安全
- 2024-09-02
仪器校准是一门技术活,对于从事生产制造的企业而言,是不可或缺的一环,因为这与产品质量密切相关。所以,了解仪器校准的相关知识也变得尤为重要。
仪器,校准

仪器校准是一门技术活,对于从事生产制造的企业而言,是不可或缺的一环,因为这与产品质量密切相关。所以,了解仪器校准的相关知识也变得尤为重要。
仪器,校准
- 2024-08-28
仪器校准以后,在仪器校准机构出具完校准证书以后,就会在所校准的仪器上贴上校准标签,校准标签上会有此次校准相关的信息,这些信息是提供给设备管理人员溯源以及巡查的参考,以方便相关人员 陈知道仪器上一次具体的校准情况信息,那么仪器校准标签有哪些常见错误?检查这几点就可以了。
仪器,校准

仪器校准以后,在仪器校准机构出具完校准证书以后,就会在所校准的仪器上贴上校准标签,校准标签上会有此次校准相关的信息,这些信息是提供给设备管理人员溯源以及巡查的参考,以方便相关人员 陈知道仪器上一次具体的校准情况信息,那么仪器校准标签有哪些常见错误?检查这几点就可以了。
仪器,校准
- 2024-08-28
对于普通消费者而言,越来越多的人开始发现UDI的存在却并不了解其意义。但对于医疗器械从业者而言,UDI早已进入视野多年,UDI不仅仅只是一个专有名词,更是一个对生命健康有效监管的预警保障,也是从业者需要积极认识并应用实施的必备工具。
UDI,标识

对于普通消费者而言,越来越多的人开始发现UDI的存在却并不了解其意义。但对于医疗器械从业者而言,UDI早已进入视野多年,UDI不仅仅只是一个专有名词,更是一个对生命健康有效监管的预警保障,也是从业者需要积极认识并应用实施的必备工具。
UDI,标识
技术资讯
- 2024-10-23
众所周知,工厂生产工业品,都要经过检验合格之后才能上市销售。特别是食品、药品、医疗器械等与人们健康息息相关的产品,检验标准尤为严格。国家药监局2019年8月发布了《国家药监局关于印发医疗器械检验工作规范的通知》,进一步规范医疗器械检验工作。
检测报告

众所周知,工厂生产工业品,都要经过检验合格之后才能上市销售。特别是食品、药品、医疗器械等与人们健康息息相关的产品,检验标准尤为严格。国家药监局2019年8月发布了《国家药监局关于印发医疗器械检验工作规范的通知》,进一步规范医疗器械检验工作。
检测报告

检测, 流程
- 2024-10-22
在用医疗器械质量检测的常见方法多种多样,这些方法旨在确保医疗器械的安全性、有效性和符合相关标准。
常见方法, 质量检测

- 2024-10-22
医疗器械检测是确保产品安全性和有效性的关键步骤。无论是在开发阶段还是在产品上市前,医疗器械检测都扮演着至关重要的角色。企业需要通过一系列严格的检测环节,才能确保产品满足各项法规要求,顺利通过监管机构的审批,进入市场。
检测流程

医疗器械检测是确保产品安全性和有效性的关键步骤。无论是在开发阶段还是在产品上市前,医疗器械检测都扮演着至关重要的角色。企业需要通过一系列严格的检测环节,才能确保产品满足各项法规要求,顺利通过监管机构的审批,进入市场。
检测流程







