技术资讯
医疗器械检测是确保产品安全性和有效性的关键步骤。无论是在开发阶段还是在产品上市前,医疗器械检测都扮演着至关重要的角色。企业需要通过一系列严格的检测环节,才能确保产品满足各项法规要求,顺利通过监管机构的审批,进入市场。
检测流程

医疗器械检测是确保产品安全性和有效性的关键步骤。无论是在开发阶段还是在产品上市前,医疗器械检测都扮演着至关重要的角色。企业需要通过一系列严格的检测环节,才能确保产品满足各项法规要求,顺利通过监管机构的审批,进入市场。
检测流程

洁净室与周围的空间必须维持一定的压差,并应按工艺要求决定维持正压差,通常情况洁净度高的区域流向洁净度低的区域,使洁净室的洁净度不受到污染空气的干扰。
控制, 洁净室
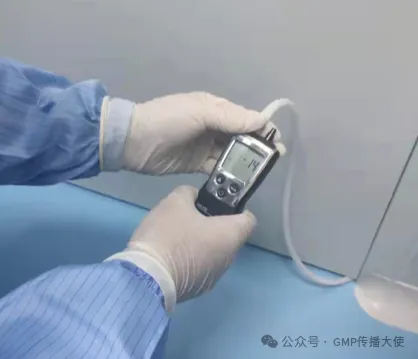
洁净室与周围的空间必须维持一定的压差,并应按工艺要求决定维持正压差,通常情况洁净度高的区域流向洁净度低的区域,使洁净室的洁净度不受到污染空气的干扰。
控制, 洁净室
无菌包装生产技术已经成熟。随着法规和检测技术的不断完善,使用企业对质量要求在逐步提高。法规和质量标准的推出将进一步规范无菌包装产品的质量和性能,从而更好地保障无菌医疗器械的安全性和有效性。
包装质量, 控制

无菌包装生产技术已经成熟。随着法规和检测技术的不断完善,使用企业对质量要求在逐步提高。法规和质量标准的推出将进一步规范无菌包装产品的质量和性能,从而更好地保障无菌医疗器械的安全性和有效性。
包装质量, 控制
国家药监局发布的《医疗器械安全和性能基本原则》中明确规定:医疗器械的设计、生产和包装,包括申请人所提供的说明和信息,应确保在按照预期用途使用时,运输和贮存条件(例如:跌落、振动、温度和湿度的波动)不会对医疗器械的特性和性能,包括完整性和清洁度,造成不利影响。
试验

国家药监局发布的《医疗器械安全和性能基本原则》中明确规定:医疗器械的设计、生产和包装,包括申请人所提供的说明和信息,应确保在按照预期用途使用时,运输和贮存条件(例如:跌落、振动、温度和湿度的波动)不会对医疗器械的特性和性能,包括完整性和清洁度,造成不利影响。
试验
技术资讯
近日,欧盟MDCG发布《隐形眼镜Master UDI-DI解决方案的实施指南》,在结构、分配、标签和注册等方面为隐形眼镜实施Master UDI-DI规则提供指引。
UDI, 标识

近日,欧盟MDCG发布《隐形眼镜Master UDI-DI解决方案的实施指南》,在结构、分配、标签和注册等方面为隐形眼镜实施Master UDI-DI规则提供指引。
UDI, 标识

本次测试依据[详细的测试标准,如 IEC 60601-1:2005 等相关标准及具体条款]对医疗器械产品进行耐压测试,以确保产品在正常使用及可能的异常电气条件下,其绝缘性能能够保障使用者的安全,防止电击事故发生。
耐压测试

本次测试依据[详细的测试标准,如 IEC 60601-1:2005 等相关标准及具体条款]对医疗器械产品进行耐压测试,以确保产品在正常使用及可能的异常电气条件下,其绝缘性能能够保障使用者的安全,防止电击事故发生。
耐压测试
水质污染的核心因素:季节变化(温度、微生物) 农业污染(农药、化肥、无机物) 工业污染(有机物) 生活污染(排泄物、微生物) 市政水消毒(氨与氯的化合物) 用户总进水(施工带来的污染)
实践, 用水3Q4, 验证

水质污染的核心因素:季节变化(温度、微生物) 农业污染(农药、化肥、无机物) 工业污染(有机物) 生活污染(排泄物、微生物) 市政水消毒(氨与氯的化合物) 用户总进水(施工带来的污染)
实践, 用水3Q4, 验证







