技术资讯
在医疗器械行业,产品的安全性和合规性一直是至关重要的问题。在上海医疗测试仪器展上,这一点尤其受到关注。为了确保医疗器械在临床使用中能够安全可靠地发挥作用,医疗器械测试是必不可少的步骤。
安全合规, 测试项目清单

在医疗器械行业,产品的安全性和合规性一直是至关重要的问题。在上海医疗测试仪器展上,这一点尤其受到关注。为了确保医疗器械在临床使用中能够安全可靠地发挥作用,医疗器械测试是必不可少的步骤。
安全合规, 测试项目清单


磁兼容性(EMC)是衡量电子设备在电磁环境中正常工作且不对该环境中任何事物构成不能承受的电磁骚扰的能力。对于医疗器械而言,由于其直接应用于人体,对EMC的要求更为严格。
医疗器械EMC
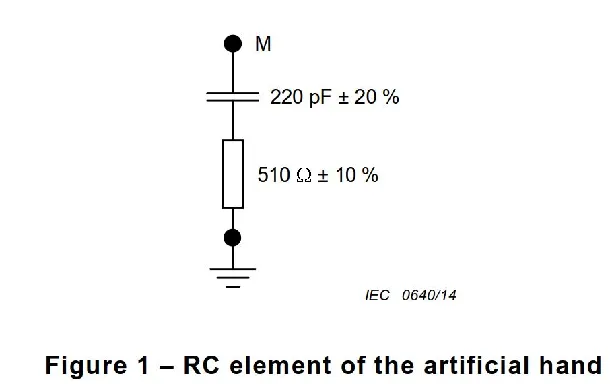
磁兼容性(EMC)是衡量电子设备在电磁环境中正常工作且不对该环境中任何事物构成不能承受的电磁骚扰的能力。对于医疗器械而言,由于其直接应用于人体,对EMC的要求更为严格。
医疗器械EMC
《新版GMP附录1:无菌药品》中无菌药品的定义为:无菌药品是指法定药品标准中列有无菌检查项目的制剂和原料药,一般包括注射剂、无菌原料药、眼用制剂、无菌软膏剂、无菌混悬剂等。药品的无菌保证取决于合理且经过验证的灭菌工艺过程、良好的无菌保证体系以及生产过程中严格的GMP管理。
压力监测, 无菌, 过滤器

《新版GMP附录1:无菌药品》中无菌药品的定义为:无菌药品是指法定药品标准中列有无菌检查项目的制剂和原料药,一般包括注射剂、无菌原料药、眼用制剂、无菌软膏剂、无菌混悬剂等。药品的无菌保证取决于合理且经过验证的灭菌工艺过程、良好的无菌保证体系以及生产过程中严格的GMP管理。
压力监测, 无菌, 过滤器
技术资讯
近日,欧盟MDCG发布《隐形眼镜Master UDI-DI解决方案的实施指南》,在结构、分配、标签和注册等方面为隐形眼镜实施Master UDI-DI规则提供指引。
UDI, 标识

近日,欧盟MDCG发布《隐形眼镜Master UDI-DI解决方案的实施指南》,在结构、分配、标签和注册等方面为隐形眼镜实施Master UDI-DI规则提供指引。
UDI, 标识

本次测试依据[详细的测试标准,如 IEC 60601-1:2005 等相关标准及具体条款]对医疗器械产品进行耐压测试,以确保产品在正常使用及可能的异常电气条件下,其绝缘性能能够保障使用者的安全,防止电击事故发生。
耐压测试

本次测试依据[详细的测试标准,如 IEC 60601-1:2005 等相关标准及具体条款]对医疗器械产品进行耐压测试,以确保产品在正常使用及可能的异常电气条件下,其绝缘性能能够保障使用者的安全,防止电击事故发生。
耐压测试
水质污染的核心因素:季节变化(温度、微生物) 农业污染(农药、化肥、无机物) 工业污染(有机物) 生活污染(排泄物、微生物) 市政水消毒(氨与氯的化合物) 用户总进水(施工带来的污染)
实践, 用水3Q4, 验证

水质污染的核心因素:季节变化(温度、微生物) 农业污染(农药、化肥、无机物) 工业污染(有机物) 生活污染(排泄物、微生物) 市政水消毒(氨与氯的化合物) 用户总进水(施工带来的污染)
实践, 用水3Q4, 验证







