首页 » 行业资讯
行业新闻
医疗器械的生产过程和加工工序必须在洁净室(区)内进行,并达到规定的洁净度级别要求,不同医疗器械适用的洁净度级别要求不一致。对洁净室(区)的工作环境必须严格控制,才能有效地防止工作环境对医疗器械的污染,保证产品质量和使用者安全。而洁净度级别的控制主要通过空调净化系统的科学合理选择、设计、维护实现。
医疗器械GMP

医疗器械的生产过程和加工工序必须在洁净室(区)内进行,并达到规定的洁净度级别要求,不同医疗器械适用的洁净度级别要求不一致。对洁净室(区)的工作环境必须严格控制,才能有效地防止工作环境对医疗器械的污染,保证产品质量和使用者安全。而洁净度级别的控制主要通过空调净化系统的科学合理选择、设计、维护实现。
医疗器械GMP
考虑器械潜在的生物学风险,并不意味着要针对所有风险点都开展生物学测试,还可通过“评价”的方式开展物理/化学表征及毒理学风险评估、基于已有的临床应用历史和人体接触数据对器械的生物学风险进行评估。在近年来更新的ISO 10993-1:2018和FDA年发布的关于ISO 10993-1的应用指南中,均强调了通过化学表征测试和毒理学风险评估(ISO 10993-18和ISO 10993-17)进行生物学评价的思路,不仅可以豁免不必要的生物相容性测试及避免人力、物力和动物资源的浪费,还可以基于已有的研究数据更加充分地评估器械(尤其是持久性植入的高风险类器械)中潜在的生物安全性风险(如慢性毒性、致癌性和生殖毒性等),从而优化生物学测试方案,最终达到器械安全性评价的目的。
生物学评价
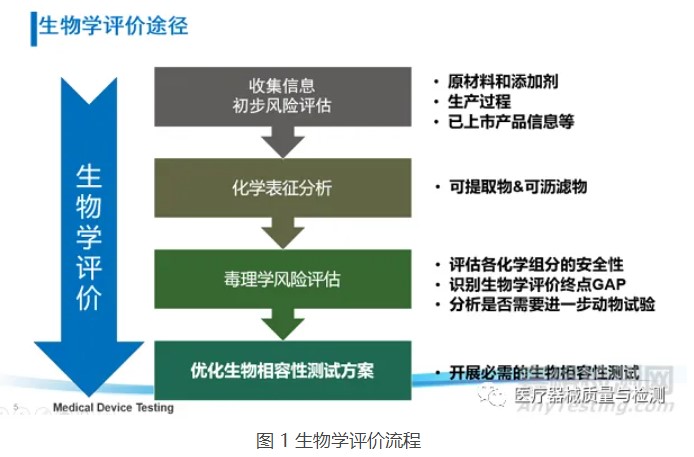
考虑器械潜在的生物学风险,并不意味着要针对所有风险点都开展生物学测试,还可通过“评价”的方式开展物理/化学表征及毒理学风险评估、基于已有的临床应用历史和人体接触数据对器械的生物学风险进行评估。在近年来更新的ISO 10993-1:2018和FDA年发布的关于ISO 10993-1的应用指南中,均强调了通过化学表征测试和毒理学风险评估(ISO 10993-18和ISO 10993-17)进行生物学评价的思路,不仅可以豁免不必要的生物相容性测试及避免人力、物力和动物资源的浪费,还可以基于已有的研究数据更加充分地评估器械(尤其是持久性植入的高风险类器械)中潜在的生物安全性风险(如慢性毒性、致癌性和生殖毒性等),从而优化生物学测试方案,最终达到器械安全性评价的目的。
生物学评价
计量行业对于数据名词的定义,往往和我们常规理解的不一样,就比如校准,通常理解的是既要测量仪器,也要“校正”仪器,把修理和检测混合一起,但是在计量行业中,校准就只是单单指数据的检测。而计量行业中正确度、精确度、精密度看上去似乎也有些相似,但实际意义却截然不同,那么计量中的正确度、精确度、精密度有什么区别?分别是什么定义?
仪器校准

计量行业对于数据名词的定义,往往和我们常规理解的不一样,就比如校准,通常理解的是既要测量仪器,也要“校正”仪器,把修理和检测混合一起,但是在计量行业中,校准就只是单单指数据的检测。而计量行业中正确度、精确度、精密度看上去似乎也有些相似,但实际意义却截然不同,那么计量中的正确度、精确度、精密度有什么区别?分别是什么定义?
仪器校准
根据ISO 10993-1:2018的定义,生物相容性是指医疗器械或材料在一个特定应用中引起恰当宿主反应的能力。“生物相容”与“生物不相容”不是某种材料天然的或绝对的“标签”,而是需要结合材料的具体性能和特定的(临床)应用场景进行判断。同时,生物相容性是一个动态概念,植入物植入人体后会对特定生物组织环境产生物理和化学影响,引起生物学反应;反之,生物组织也会对植入物产生影响,使之发生物理或化学变化,两者的相互作用会一直持续。即使植入物被完全去除或被人体完全吸收,其影响还将持续一段时间。
相容性评价

根据ISO 10993-1:2018的定义,生物相容性是指医疗器械或材料在一个特定应用中引起恰当宿主反应的能力。“生物相容”与“生物不相容”不是某种材料天然的或绝对的“标签”,而是需要结合材料的具体性能和特定的(临床)应用场景进行判断。同时,生物相容性是一个动态概念,植入物植入人体后会对特定生物组织环境产生物理和化学影响,引起生物学反应;反之,生物组织也会对植入物产生影响,使之发生物理或化学变化,两者的相互作用会一直持续。即使植入物被完全去除或被人体完全吸收,其影响还将持续一段时间。
相容性评价
MSR的征求意见稿于2022年的2月发布,正式版本于2024年2月发布,2026年2月2日生效,制造商有两年的时间来调整内部流程和程序。美国FDA医疗器械质量体系法规俗称为QSR820。其中820是指的是美国联邦法规的第820章节。Q代表quality,S代表system,R代表regulation。美国FDA对QSR820质量体系进行修订,引进了国际标准化组织ISO13485-2016版本取代现有的大部分法规,更改后的质量体系新规叫做:QMSR(Quality Management System Regulation)
质量体系, 质量管理
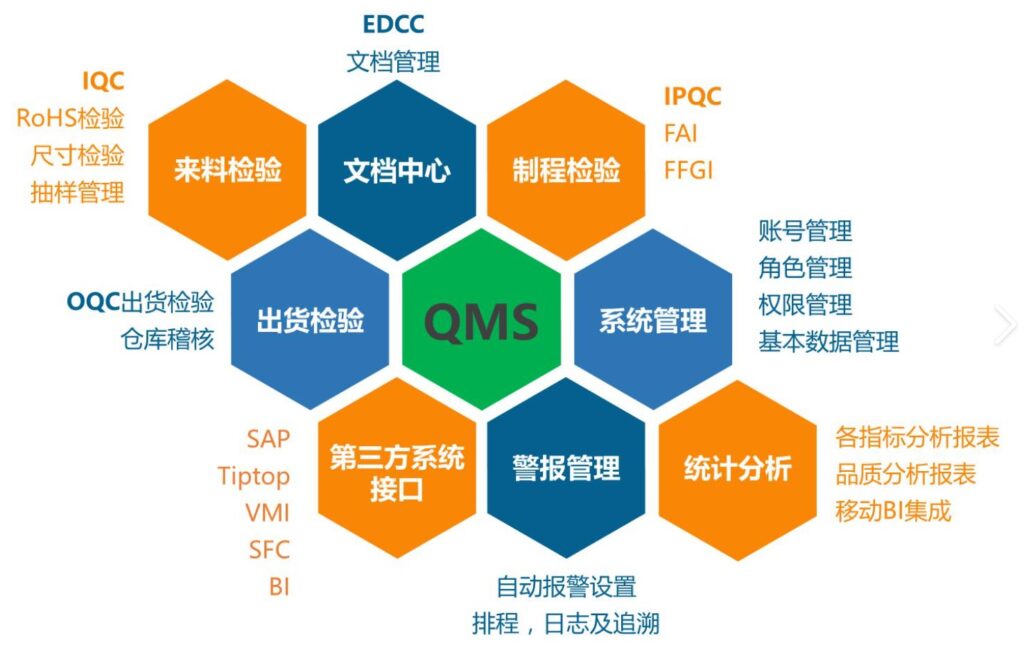
MSR的征求意见稿于2022年的2月发布,正式版本于2024年2月发布,2026年2月2日生效,制造商有两年的时间来调整内部流程和程序。美国FDA医疗器械质量体系法规俗称为QSR820。其中820是指的是美国联邦法规的第820章节。Q代表quality,S代表system,R代表regulation。美国FDA对QSR820质量体系进行修订,引进了国际标准化组织ISO13485-2016版本取代现有的大部分法规,更改后的质量体系新规叫做:QMSR(Quality Management System Regulation)
质量体系, 质量管理
行业新闻
PART 830—唯一设备标识(UDI) 是美国食品药品监督管理局(FDA)制定的一个法规,旨在为医疗器械创建一个标准化的识别系统。
UDI
PART 830—唯一设备标识(UDI) 是美国食品药品监督管理局(FDA)制定的一个法规,旨在为医疗器械创建一个标准化的识别系统。
UDI


医疗机构对于仪器管理都比较重视,一般还会成立专门的品管部,每到一定时间就会对机构内的仪器进行检测维护,如果不及时进行仪器校准维护,更新相关的医疗仪器校准证书,相关部门的检查就很难通过,并且还会埋藏较大的安全隐患。那么医疗仪器校准证书有效期是怎样进行规定的?多久校准一次?医疗质量检测技术展为您进行详细介绍。
仪器校准
医疗机构对于仪器管理都比较重视,一般还会成立专门的品管部,每到一定时间就会对机构内的仪器进行检测维护,如果不及时进行仪器校准维护,更新相关的医疗仪器校准证书,相关部门的检查就很难通过,并且还会埋藏较大的安全隐患。那么医疗仪器校准证书有效期是怎样进行规定的?多久校准一次?医疗质量检测技术展为您进行详细介绍。
仪器校准
环氧乙烷灭菌在医疗器械灭菌领域具有不可替代的地位,尤其对于那些无法承受高温高压环境的精密器械以及一次性使用医疗器械而言,是确保其无菌性的关键工艺。然而,这一灭菌过程受到多种复杂因素的交互影响,任何一个环节的波动都可能导致灭菌效果偏离预期。
环氧乙烷灭菌

环氧乙烷灭菌在医疗器械灭菌领域具有不可替代的地位,尤其对于那些无法承受高温高压环境的精密器械以及一次性使用医疗器械而言,是确保其无菌性的关键工艺。然而,这一灭菌过程受到多种复杂因素的交互影响,任何一个环节的波动都可能导致灭菌效果偏离预期。
环氧乙烷灭菌






