首页 » 行业资讯
行业新闻
仪器校准以后,在仪器校准机构出具完校准证书以后,就会在所校准的仪器上贴上校准标签,校准标签上会有此次校准相关的信息,这些信息是提供给设备管理人员溯源以及巡查的参考,以方便相关人员 陈知道仪器上一次具体的校准情况信息,那么仪器校准标签有哪些常见错误?检查这几点就可以了。
仪器,校准

仪器校准以后,在仪器校准机构出具完校准证书以后,就会在所校准的仪器上贴上校准标签,校准标签上会有此次校准相关的信息,这些信息是提供给设备管理人员溯源以及巡查的参考,以方便相关人员 陈知道仪器上一次具体的校准情况信息,那么仪器校准标签有哪些常见错误?检查这几点就可以了。
仪器,校准
对于普通消费者而言,越来越多的人开始发现UDI的存在却并不了解其意义。但对于医疗器械从业者而言,UDI早已进入视野多年,UDI不仅仅只是一个专有名词,更是一个对生命健康有效监管的预警保障,也是从业者需要积极认识并应用实施的必备工具。
UDI,标识

对于普通消费者而言,越来越多的人开始发现UDI的存在却并不了解其意义。但对于医疗器械从业者而言,UDI早已进入视野多年,UDI不仅仅只是一个专有名词,更是一个对生命健康有效监管的预警保障,也是从业者需要积极认识并应用实施的必备工具。
UDI,标识
在进行医疗期器械软件设计过程中,我们可以从以下18点来进行技术考量。分别为1.注册单元与检测单元、2.临床评价基本原则、3.网络安全、4.云计算、5.移动计算、6.人工智能、7.人因与可用性、8.互操作性、9.测量功能、10.远程访问与控制、11.通用计算平台、12.非医疗器械功能、13.植入产品设计软件、14.使用期限、15.异常处理、16.功能安全与软件可靠性、17.GB/T25000.51实施要求和18.进口医疗器械软件等要求。
质量管理,设计
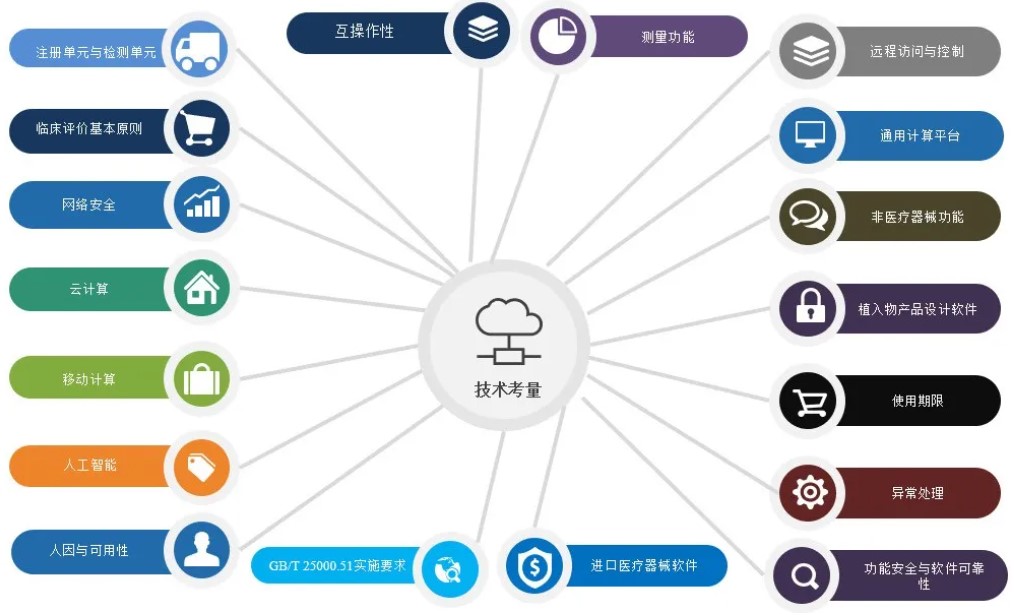
在进行医疗期器械软件设计过程中,我们可以从以下18点来进行技术考量。分别为1.注册单元与检测单元、2.临床评价基本原则、3.网络安全、4.云计算、5.移动计算、6.人工智能、7.人因与可用性、8.互操作性、9.测量功能、10.远程访问与控制、11.通用计算平台、12.非医疗器械功能、13.植入产品设计软件、14.使用期限、15.异常处理、16.功能安全与软件可靠性、17.GB/T25000.51实施要求和18.进口医疗器械软件等要求。
质量管理,设计
对于拟使用的同品种医疗器械非公开数据等需要提供授权,以保证数据来源的合法性;使用公开发表的数据,如公开发表的文献、数据、信息等,不需取得授权。数据如果来自公开数据、试验测量、行业共识等,不需取得授权。
质量管理,授权
对于拟使用的同品种医疗器械非公开数据等需要提供授权,以保证数据来源的合法性;使用公开发表的数据,如公开发表的文献、数据、信息等,不需取得授权。数据如果来自公开数据、试验测量、行业共识等,不需取得授权。
质量管理,授权
测试完成后,您将需要制作一份可用性工程报告,该报告需要提交给您的医疗设备销售市场的相应监管机构。需要注意的是,这份报告不应该简单地总结你的可用性验证测试,而是需要一个非常具体的格式。
可用性测试
测试完成后,您将需要制作一份可用性工程报告,该报告需要提交给您的医疗设备销售市场的相应监管机构。需要注意的是,这份报告不应该简单地总结你的可用性验证测试,而是需要一个非常具体的格式。
可用性测试
行业新闻
PART 830—唯一设备标识(UDI) 是美国食品药品监督管理局(FDA)制定的一个法规,旨在为医疗器械创建一个标准化的识别系统。
UDI
PART 830—唯一设备标识(UDI) 是美国食品药品监督管理局(FDA)制定的一个法规,旨在为医疗器械创建一个标准化的识别系统。
UDI


医疗机构对于仪器管理都比较重视,一般还会成立专门的品管部,每到一定时间就会对机构内的仪器进行检测维护,如果不及时进行仪器校准维护,更新相关的医疗仪器校准证书,相关部门的检查就很难通过,并且还会埋藏较大的安全隐患。那么医疗仪器校准证书有效期是怎样进行规定的?多久校准一次?医疗质量检测技术展为您进行详细介绍。
仪器校准
医疗机构对于仪器管理都比较重视,一般还会成立专门的品管部,每到一定时间就会对机构内的仪器进行检测维护,如果不及时进行仪器校准维护,更新相关的医疗仪器校准证书,相关部门的检查就很难通过,并且还会埋藏较大的安全隐患。那么医疗仪器校准证书有效期是怎样进行规定的?多久校准一次?医疗质量检测技术展为您进行详细介绍。
仪器校准
环氧乙烷灭菌在医疗器械灭菌领域具有不可替代的地位,尤其对于那些无法承受高温高压环境的精密器械以及一次性使用医疗器械而言,是确保其无菌性的关键工艺。然而,这一灭菌过程受到多种复杂因素的交互影响,任何一个环节的波动都可能导致灭菌效果偏离预期。
环氧乙烷灭菌

环氧乙烷灭菌在医疗器械灭菌领域具有不可替代的地位,尤其对于那些无法承受高温高压环境的精密器械以及一次性使用医疗器械而言,是确保其无菌性的关键工艺。然而,这一灭菌过程受到多种复杂因素的交互影响,任何一个环节的波动都可能导致灭菌效果偏离预期。
环氧乙烷灭菌






