首页 » 行业资讯
行业新闻
在医疗器械的开发过程中,确保产品的可靠性和安全性是至关重要的任务。为了实现这一目标,失效模式和影响分析(FMEA)成为了设计和风险管理的核心工具之一。FMEA 是一种系统的方法,通过识别和评估潜在的失效模式及其对系统、用户和环境的影响,帮助开发团队预防和减少产品故障。
安全性, 质量管理
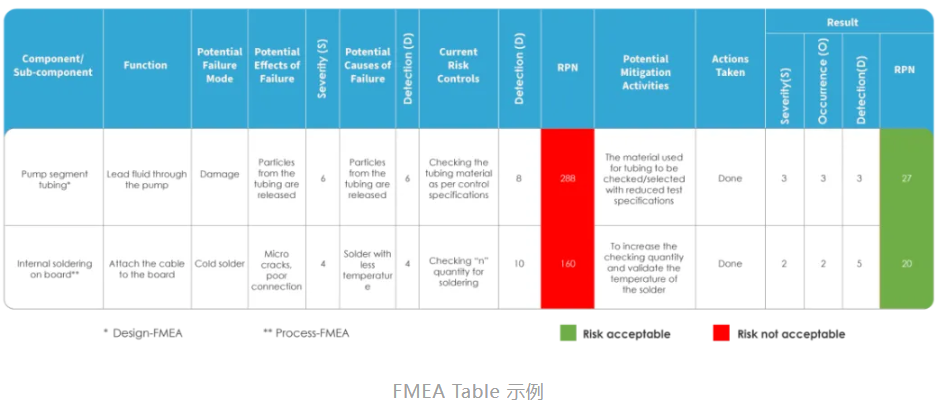
在医疗器械的开发过程中,确保产品的可靠性和安全性是至关重要的任务。为了实现这一目标,失效模式和影响分析(FMEA)成为了设计和风险管理的核心工具之一。FMEA 是一种系统的方法,通过识别和评估潜在的失效模式及其对系统、用户和环境的影响,帮助开发团队预防和减少产品故障。
安全性, 质量管理
医疗器械生物相容性评价是一个复杂而细致的过程,它要求对医疗器械的各个方面进行全面考量。随着科技的发展和标准的完善,生物相容性评价将继续发展,以确保医疗器械的安全性和有效性,保护患者的健康。
相容性, 质量管理

医疗器械生物相容性评价是一个复杂而细致的过程,它要求对医疗器械的各个方面进行全面考量。随着科技的发展和标准的完善,生物相容性评价将继续发展,以确保医疗器械的安全性和有效性,保护患者的健康。
相容性, 质量管理
随着现代工业的发展,泄漏问题已经成为许多行业面临的重要挑战。高精度泄漏测试仪作为专业的检测设备,以其独特的特点和明显的优势,在泄漏检测领域发挥着越来越重要的作用。
上腾科技

随着现代工业的发展,泄漏问题已经成为许多行业面临的重要挑战。高精度泄漏测试仪作为专业的检测设备,以其独特的特点和明显的优势,在泄漏检测领域发挥着越来越重要的作用。
上腾科技
在医疗器械领域国家政策频吹暖风的大背景下,这个预期颇丰的市场更受到投资人青睐。然而,在利好声一片的国内医疗器械领域中却出现了“瘸腿”失衡现象,即生产诊断类产品的企业远远多于治疗类企业,进而也直接导致诊断类产品的投资份额所占更多。
必智科技

在医疗器械领域国家政策频吹暖风的大背景下,这个预期颇丰的市场更受到投资人青睐。然而,在利好声一片的国内医疗器械领域中却出现了“瘸腿”失衡现象,即生产诊断类产品的企业远远多于治疗类企业,进而也直接导致诊断类产品的投资份额所占更多。
必智科技
安徽英太自动化科技有限公司以全球检漏市场为导向,立足于气密检漏仪、气密检漏系统的研发、生产及销售并提供一站式的气密检漏解决方案。
安徽英太

安徽英太自动化科技有限公司以全球检漏市场为导向,立足于气密检漏仪、气密检漏系统的研发、生产及销售并提供一站式的气密检漏解决方案。
安徽英太
行业新闻
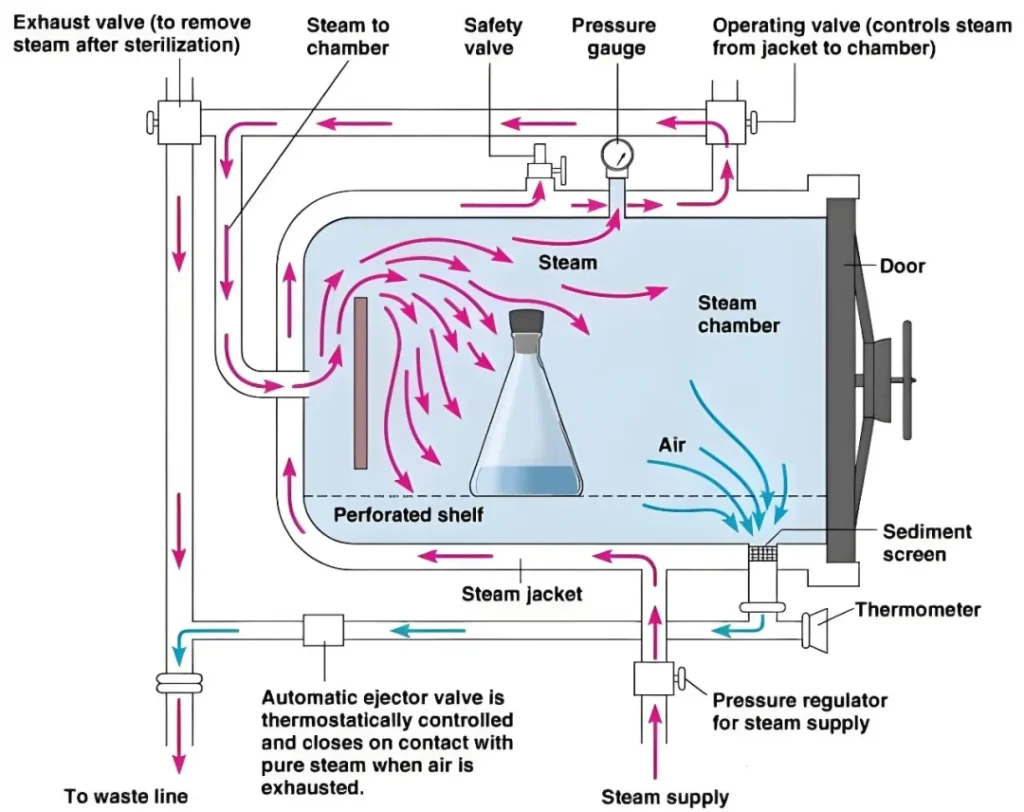
通过对工艺用水系统的全面验证,确保该系统能够连续稳定地供应满足生产需求的水量,并证明制水过程能够在长期内持续制备出符合《医疗器械生产质量管理规范-无菌医疗器械实施细则》要求的工艺用水。
用水验证

通过对工艺用水系统的全面验证,确保该系统能够连续稳定地供应满足生产需求的水量,并证明制水过程能够在长期内持续制备出符合《医疗器械生产质量管理规范-无菌医疗器械实施细则》要求的工艺用水。
用水验证
在医疗器械行业,验证(Verification)与确认(Validation)不仅仅是质量管理的基本要素,更是确保产品安全、有效性的关键步骤。在医疗质量检测技术及测试仪器展上,这些关键步骤得到了特别的关注和展示。
验证与确认
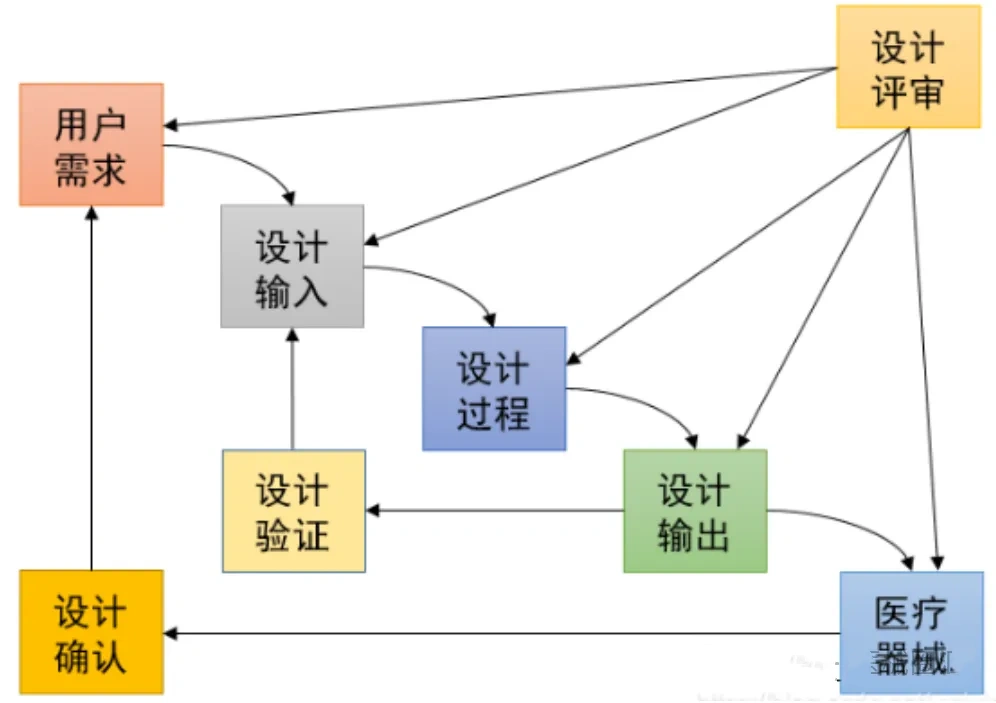
在医疗器械行业,验证(Verification)与确认(Validation)不仅仅是质量管理的基本要素,更是确保产品安全、有效性的关键步骤。在医疗质量检测技术及测试仪器展上,这些关键步骤得到了特别的关注和展示。
验证与确认
ISO13485:2016《医疗器械质量管理体系用于法规的要求》,由ISO国际标准化组织于2016年3月1 日正式发布,是一项应用于医疗器械领域的质量管理体系的国际标准,强调医疗器械的安全有效,组织提供的医疗器械要满足顾客和法规要求。
ISO13485和GB/T42061, 输入
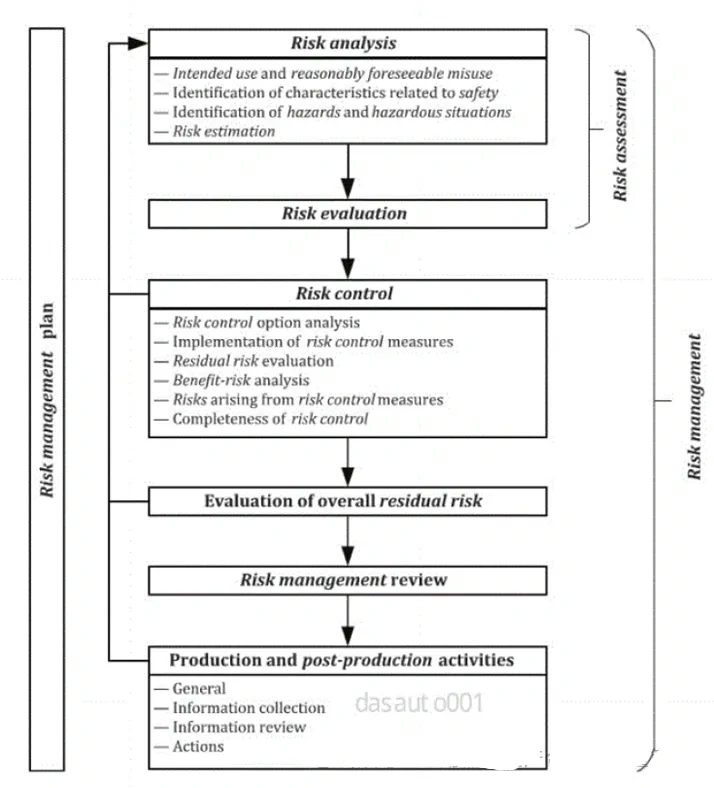
ISO13485:2016《医疗器械质量管理体系用于法规的要求》,由ISO国际标准化组织于2016年3月1 日正式发布,是一项应用于医疗器械领域的质量管理体系的国际标准,强调医疗器械的安全有效,组织提供的医疗器械要满足顾客和法规要求。
ISO13485和GB/T42061, 输入
生产企业应当按照医疗器械生产质量管理规范的要求,结合产品特点,建立健全与所生产医疗器械相适应的质量管理体系,并保证其有效运行。在医疗质量检测技术展上,这些生产企业将有机会展示他们如何遵循这些规范,并通过先进的质量管理系统确保其产品的高标准和可靠性。
GMP, 生产质量管理
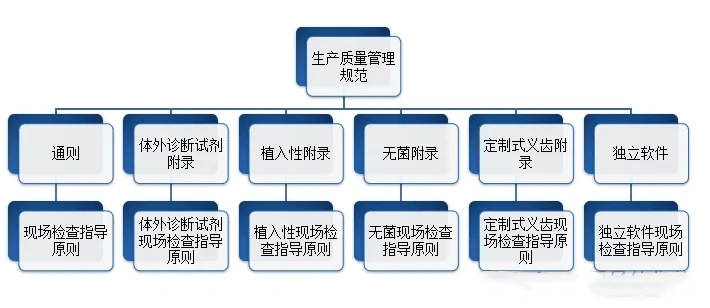
生产企业应当按照医疗器械生产质量管理规范的要求,结合产品特点,建立健全与所生产医疗器械相适应的质量管理体系,并保证其有效运行。在医疗质量检测技术展上,这些生产企业将有机会展示他们如何遵循这些规范,并通过先进的质量管理系统确保其产品的高标准和可靠性。
GMP, 生产质量管理






