首页 » 行业资讯
行业新闻
3C 电子产品日益增长的需求给精密加工行业的供应商带来了多方面的挑战。由于使用了新材料,制造商对表面质量提出了更高的要求。更严峻的挑战是,与其他制造工艺相比,机械加工工艺非常复杂,因此很难开发出稳定的制造工艺和工具设计。在大规模生产中,刀具磨损是影响产品质量和成本的关键因素。
奇石乐精密机械

3C 电子产品日益增长的需求给精密加工行业的供应商带来了多方面的挑战。由于使用了新材料,制造商对表面质量提出了更高的要求。更严峻的挑战是,与其他制造工艺相比,机械加工工艺非常复杂,因此很难开发出稳定的制造工艺和工具设计。在大规模生产中,刀具磨损是影响产品质量和成本的关键因素。
奇石乐精密机械
近日,济南众测机电设备有限公司(以下简称“济南众测”)与多家第三方检测机构——中检华通威、华测集团、科标医学、熠品检测以及湖南新领航、谱尼检测等建立了深度合作。通过济南众测提供的先进医疗器械检测仪器,共同开拓并深化医疗器械检测服务市场,为医疗行业的健康发展保驾护航。
济南众测

近日,济南众测机电设备有限公司(以下简称“济南众测”)与多家第三方检测机构——中检华通威、华测集团、科标医学、熠品检测以及湖南新领航、谱尼检测等建立了深度合作。通过济南众测提供的先进医疗器械检测仪器,共同开拓并深化医疗器械检测服务市场,为医疗行业的健康发展保驾护航。
济南众测
医疗器械摸底测试是在医疗器械开发的早期阶段进行的初步测试,旨在了解医疗器械的基本性能和特征,初步评估其适应性和可行性,防止在医疗器械注册检验过程中耽误更多的时间,延缓上市周期。
测试, 质量管理

医疗器械摸底测试是在医疗器械开发的早期阶段进行的初步测试,旨在了解医疗器械的基本性能和特征,初步评估其适应性和可行性,防止在医疗器械注册检验过程中耽误更多的时间,延缓上市周期。
测试, 质量管理
设计变更是一个关键的医疗器械质量管理体系中的环节,需要我们采取适当的步骤,确保变更的安全性、有效性以及符合法规要求。结合以往实战经验,提供以下是一些实施建议,期望可以帮助我们在设计变更活动中做得更好:
质量管理

设计变更是一个关键的医疗器械质量管理体系中的环节,需要我们采取适当的步骤,确保变更的安全性、有效性以及符合法规要求。结合以往实战经验,提供以下是一些实施建议,期望可以帮助我们在设计变更活动中做得更好:
质量管理
医疗器械的安全性和有效性是医疗健康领域的核心关注点。设计验证是确保医疗器械满足预期使用要求的关键步骤,而稳定性测试则是设计验证中的重要组成部分。本文旨在分享稳定性测试的重点方面,以及如何在实际工作中进行有效实施。
设计, 质量管理, 验证
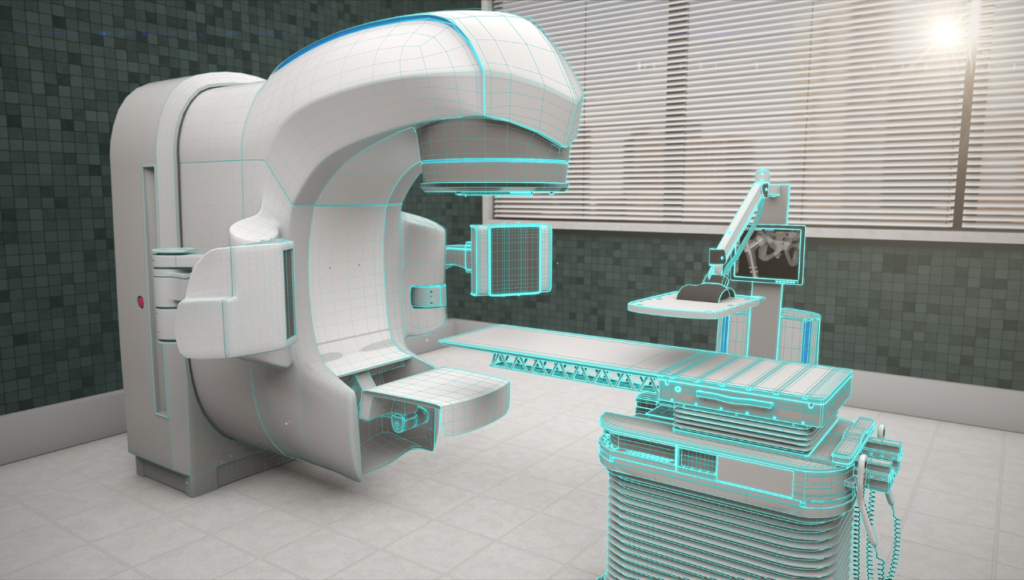
医疗器械的安全性和有效性是医疗健康领域的核心关注点。设计验证是确保医疗器械满足预期使用要求的关键步骤,而稳定性测试则是设计验证中的重要组成部分。本文旨在分享稳定性测试的重点方面,以及如何在实际工作中进行有效实施。
设计, 质量管理, 验证
行业新闻
通过对工艺用水系统的全面验证,确保该系统能够连续稳定地供应满足生产需求的水量,并证明制水过程能够在长期内持续制备出符合《医疗器械生产质量管理规范-无菌医疗器械实施细则》要求的工艺用水。
用水验证

通过对工艺用水系统的全面验证,确保该系统能够连续稳定地供应满足生产需求的水量,并证明制水过程能够在长期内持续制备出符合《医疗器械生产质量管理规范-无菌医疗器械实施细则》要求的工艺用水。
用水验证
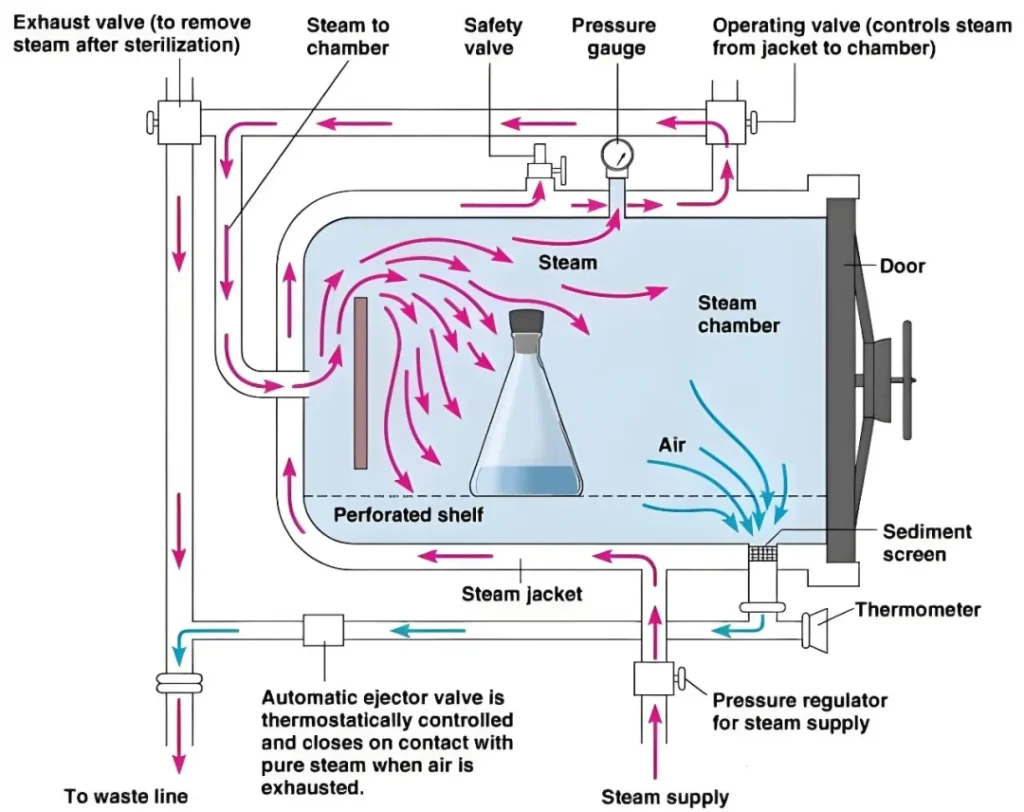
在医疗器械行业,验证(Verification)与确认(Validation)不仅仅是质量管理的基本要素,更是确保产品安全、有效性的关键步骤。在医疗质量检测技术及测试仪器展上,这些关键步骤得到了特别的关注和展示。
验证与确认
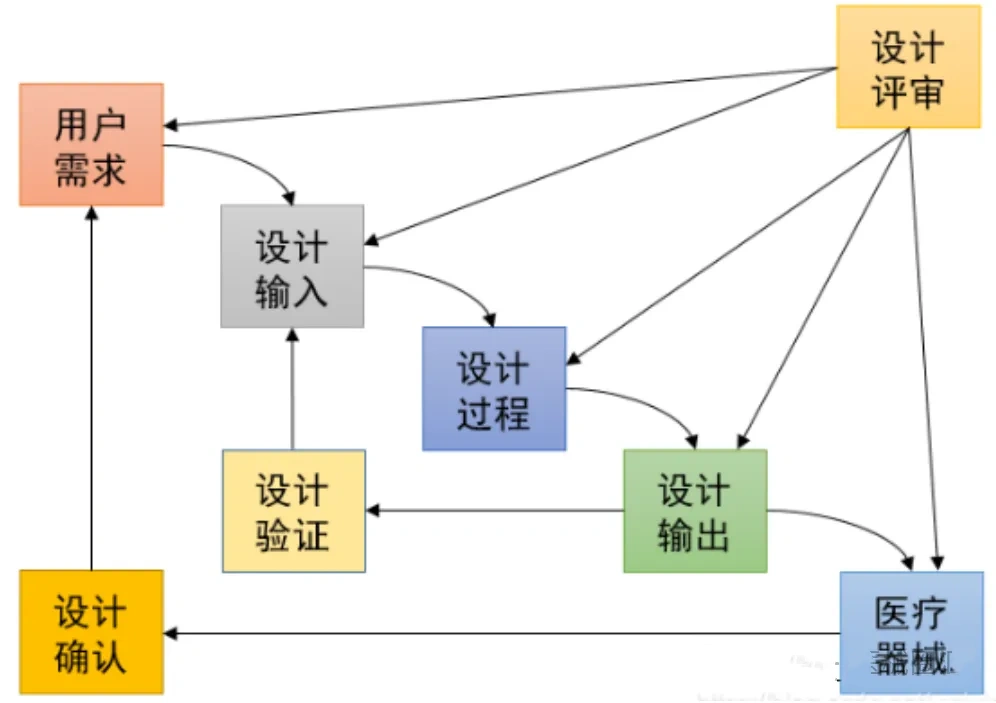
在医疗器械行业,验证(Verification)与确认(Validation)不仅仅是质量管理的基本要素,更是确保产品安全、有效性的关键步骤。在医疗质量检测技术及测试仪器展上,这些关键步骤得到了特别的关注和展示。
验证与确认
ISO13485:2016《医疗器械质量管理体系用于法规的要求》,由ISO国际标准化组织于2016年3月1 日正式发布,是一项应用于医疗器械领域的质量管理体系的国际标准,强调医疗器械的安全有效,组织提供的医疗器械要满足顾客和法规要求。
ISO13485和GB/T42061, 输入
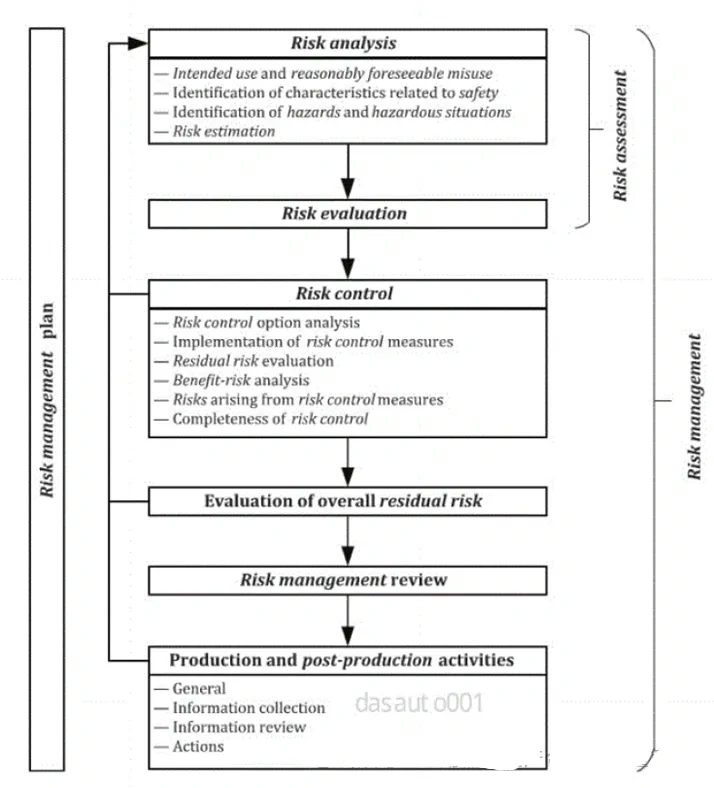
ISO13485:2016《医疗器械质量管理体系用于法规的要求》,由ISO国际标准化组织于2016年3月1 日正式发布,是一项应用于医疗器械领域的质量管理体系的国际标准,强调医疗器械的安全有效,组织提供的医疗器械要满足顾客和法规要求。
ISO13485和GB/T42061, 输入
生产企业应当按照医疗器械生产质量管理规范的要求,结合产品特点,建立健全与所生产医疗器械相适应的质量管理体系,并保证其有效运行。在医疗质量检测技术展上,这些生产企业将有机会展示他们如何遵循这些规范,并通过先进的质量管理系统确保其产品的高标准和可靠性。
GMP, 生产质量管理
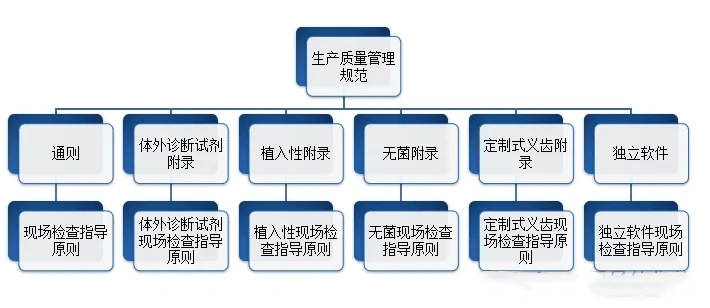
生产企业应当按照医疗器械生产质量管理规范的要求,结合产品特点,建立健全与所生产医疗器械相适应的质量管理体系,并保证其有效运行。在医疗质量检测技术展上,这些生产企业将有机会展示他们如何遵循这些规范,并通过先进的质量管理系统确保其产品的高标准和可靠性。
GMP, 生产质量管理






