首页 » 行业资讯
行业新闻
医疗器械检测是确保产品安全性和有效性的关键步骤。无论是在开发阶段还是在产品上市前,医疗器械检测都扮演着至关重要的角色。企业需要通过一系列严格的检测环节,才能确保产品满足各项法规要求,顺利通过监管机构的审批,进入市场。
检测流程

医疗器械检测是确保产品安全性和有效性的关键步骤。无论是在开发阶段还是在产品上市前,医疗器械检测都扮演着至关重要的角色。企业需要通过一系列严格的检测环节,才能确保产品满足各项法规要求,顺利通过监管机构的审批,进入市场。
检测流程

洁净室与周围的空间必须维持一定的压差,并应按工艺要求决定维持正压差,通常情况洁净度高的区域流向洁净度低的区域,使洁净室的洁净度不受到污染空气的干扰。
控制, 洁净室
洁净室与周围的空间必须维持一定的压差,并应按工艺要求决定维持正压差,通常情况洁净度高的区域流向洁净度低的区域,使洁净室的洁净度不受到污染空气的干扰。
控制, 洁净室
无菌包装生产技术已经成熟。随着法规和检测技术的不断完善,使用企业对质量要求在逐步提高。法规和质量标准的推出将进一步规范无菌包装产品的质量和性能,从而更好地保障无菌医疗器械的安全性和有效性。
包装质量, 控制

无菌包装生产技术已经成熟。随着法规和检测技术的不断完善,使用企业对质量要求在逐步提高。法规和质量标准的推出将进一步规范无菌包装产品的质量和性能,从而更好地保障无菌医疗器械的安全性和有效性。
包装质量, 控制
国家药监局发布的《医疗器械安全和性能基本原则》中明确规定:医疗器械的设计、生产和包装,包括申请人所提供的说明和信息,应确保在按照预期用途使用时,运输和贮存条件(例如:跌落、振动、温度和湿度的波动)不会对医疗器械的特性和性能,包括完整性和清洁度,造成不利影响。
试验

国家药监局发布的《医疗器械安全和性能基本原则》中明确规定:医疗器械的设计、生产和包装,包括申请人所提供的说明和信息,应确保在按照预期用途使用时,运输和贮存条件(例如:跌落、振动、温度和湿度的波动)不会对医疗器械的特性和性能,包括完整性和清洁度,造成不利影响。
试验
行业新闻
在用医疗器械质量检测的常见方法多种多样,这些方法旨在确保医疗器械的安全性、有效性和符合相关标准。以下是一些主要的检测方法:
质量检测

在用医疗器械质量检测的常见方法多种多样,这些方法旨在确保医疗器械的安全性、有效性和符合相关标准。以下是一些主要的检测方法:
质量检测

根据法规要求,医疗器械的说明书、标签应当标示医疗器械生产日期及使用期限(或失效日期),即标示 “生产日期 + 使用期限” 或 “生产日期 + 失效日期”。
失效期, 有效期, 界定

根据法规要求,医疗器械的说明书、标签应当标示医疗器械生产日期及使用期限(或失效日期),即标示 “生产日期 + 使用期限” 或 “生产日期 + 失效日期”。
失效期, 有效期, 界定
本篇内容为学习总结,源自审评二部陈敏老师关于《有源医疗器械注册申报资料要求及常见问题介绍》在器审中心学习云课程的视频。陈老师主要介绍了共性问题、研究资料-联合使用、研究资料-生物学特性、研究资料-清洁、消毒、灭菌、稳定性和92个技术审评共性问题等六个方面。
有源医疗器械, 评审
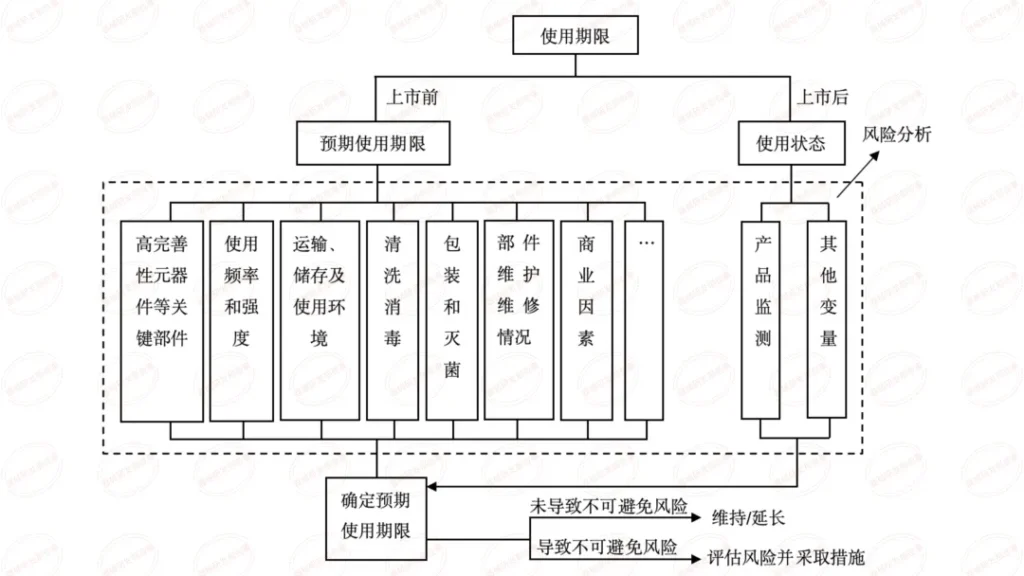
本篇内容为学习总结,源自审评二部陈敏老师关于《有源医疗器械注册申报资料要求及常见问题介绍》在器审中心学习云课程的视频。陈老师主要介绍了共性问题、研究资料-联合使用、研究资料-生物学特性、研究资料-清洁、消毒、灭菌、稳定性和92个技术审评共性问题等六个方面。
有源医疗器械, 评审