首页 » 行业资讯
行业新闻
企业生产医疗器械时,为确认产品性能指标以及生产和检验环境的洁净度,需要对产品性能指标、洁净区环境、工艺用水、产品无菌性能、环氧乙烷残留量(EO灭菌)等进行检验。质量检验的结果是否准确可靠,取决于检验设备测量的结果的准确性,企业在使用检验设备时,需要提供客观证据,证明设备符合要求。
检验设备,GMP

企业生产医疗器械时,为确认产品性能指标以及生产和检验环境的洁净度,需要对产品性能指标、洁净区环境、工艺用水、产品无菌性能、环氧乙烷残留量(EO灭菌)等进行检验。质量检验的结果是否准确可靠,取决于检验设备测量的结果的准确性,企业在使用检验设备时,需要提供客观证据,证明设备符合要求。
检验设备,GMP
A:维氏硬度检测不需要提供单独的试样,在送检样品上取样测试;洛氏硬度检测若被测部位形状不规则时,无法直接对样品进行测试,应提供原材料试样块,并提供材质、热处理工艺一致性声明。
注册

A:维氏硬度检测不需要提供单独的试样,在送检样品上取样测试;洛氏硬度检测若被测部位形状不规则时,无法直接对样品进行测试,应提供原材料试样块,并提供材质、热处理工艺一致性声明。
注册
同品种比对是医疗器械注册申报过程中进行临床评价的重要方式之一,包括通过等同器械的临床数据进行临床评价以及使用可比器械的临床数据进行部分临床评价。同品种比对是企业节省大量研发费用,缩短新产品上市时间的优先选择。
临床评价
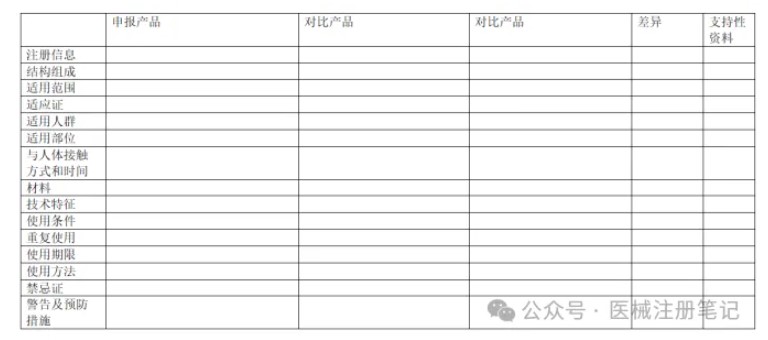
同品种比对是医疗器械注册申报过程中进行临床评价的重要方式之一,包括通过等同器械的临床数据进行临床评价以及使用可比器械的临床数据进行部分临床评价。同品种比对是企业节省大量研发费用,缩短新产品上市时间的优先选择。
临床评价
医疗器械注册阶段,货架有效期部分研究至关重要,货架有效期研究是确保产品在规定期限内能够正常发挥预期功能的重要证据。当医疗器械超过货架有效期研究规定的最大期限,器械的性能可能无法得到保证,在使用时则存在潜在风险。
安全性评价
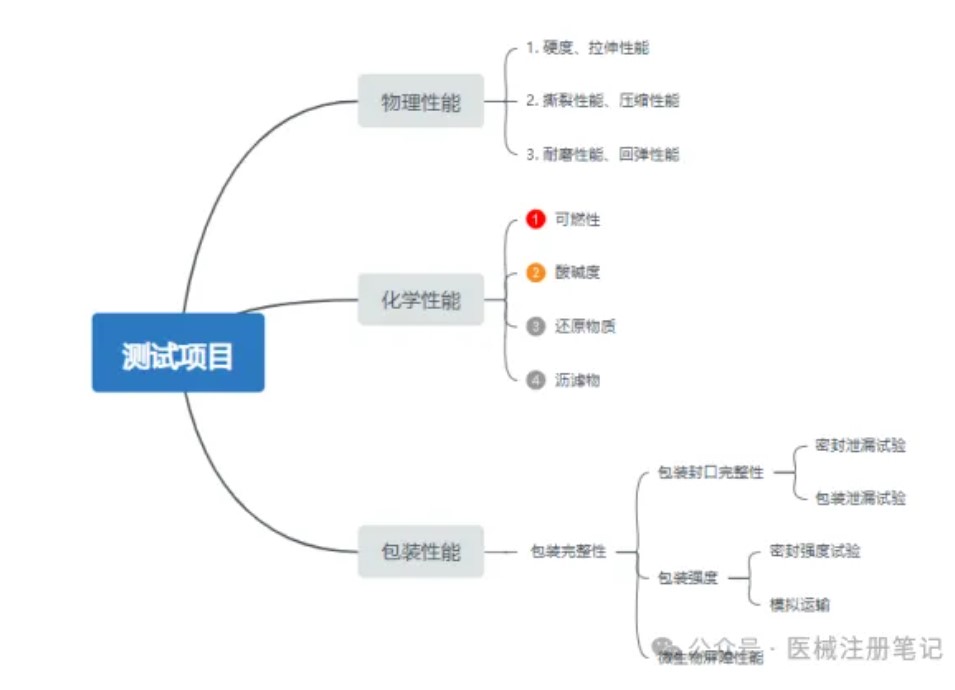
医疗器械注册阶段,货架有效期部分研究至关重要,货架有效期研究是确保产品在规定期限内能够正常发挥预期功能的重要证据。当医疗器械超过货架有效期研究规定的最大期限,器械的性能可能无法得到保证,在使用时则存在潜在风险。
安全性评价
TOS9300系列是一款高性能安规试验仪,可帮助您执行符合各种标准的医用电气设备的安规测试。此系列涵盖高压绝缘耐压测试,绝缘电阻,接地阻抗,泄漏电流(接触电流和保护导体电流)以及局部放电测试。该多功能测试仪提高了生产效率并节约了宝贵的生产空间,是研发,质量保证,生产线和实验室的理想选择。
测试仪
TOS9300系列是一款高性能安规试验仪,可帮助您执行符合各种标准的医用电气设备的安规测试。此系列涵盖高压绝缘耐压测试,绝缘电阻,接地阻抗,泄漏电流(接触电流和保护导体电流)以及局部放电测试。该多功能测试仪提高了生产效率并节约了宝贵的生产空间,是研发,质量保证,生产线和实验室的理想选择。
测试仪
行业新闻
在用医疗器械质量检测的常见方法多种多样,这些方法旨在确保医疗器械的安全性、有效性和符合相关标准。以下是一些主要的检测方法:
质量检测

在用医疗器械质量检测的常见方法多种多样,这些方法旨在确保医疗器械的安全性、有效性和符合相关标准。以下是一些主要的检测方法:
质量检测

根据法规要求,医疗器械的说明书、标签应当标示医疗器械生产日期及使用期限(或失效日期),即标示 “生产日期 + 使用期限” 或 “生产日期 + 失效日期”。
失效期, 有效期, 界定

根据法规要求,医疗器械的说明书、标签应当标示医疗器械生产日期及使用期限(或失效日期),即标示 “生产日期 + 使用期限” 或 “生产日期 + 失效日期”。
失效期, 有效期, 界定
本篇内容为学习总结,源自审评二部陈敏老师关于《有源医疗器械注册申报资料要求及常见问题介绍》在器审中心学习云课程的视频。陈老师主要介绍了共性问题、研究资料-联合使用、研究资料-生物学特性、研究资料-清洁、消毒、灭菌、稳定性和92个技术审评共性问题等六个方面。
有源医疗器械, 评审
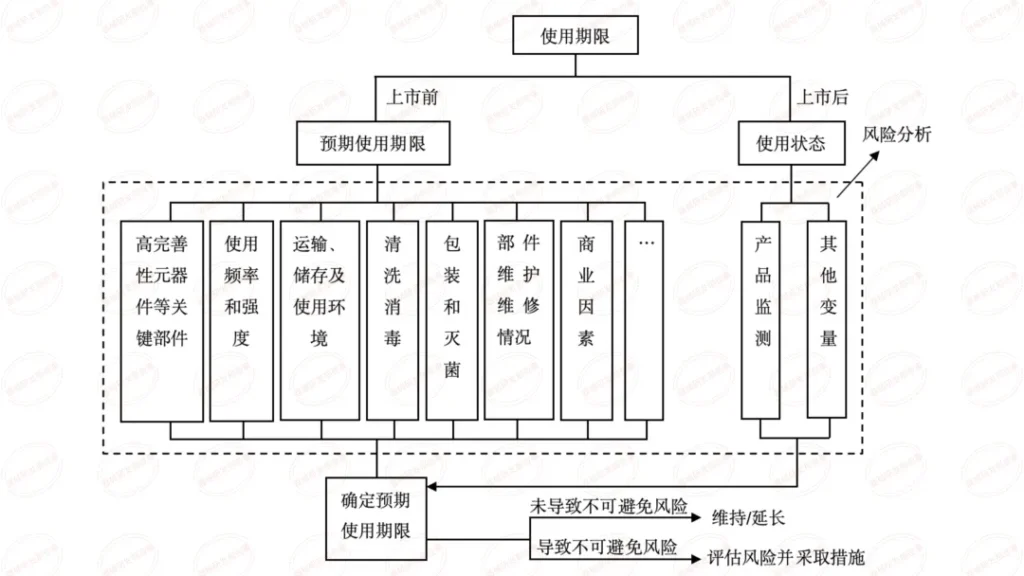
本篇内容为学习总结,源自审评二部陈敏老师关于《有源医疗器械注册申报资料要求及常见问题介绍》在器审中心学习云课程的视频。陈老师主要介绍了共性问题、研究资料-联合使用、研究资料-生物学特性、研究资料-清洁、消毒、灭菌、稳定性和92个技术审评共性问题等六个方面。
有源医疗器械, 评审