首页 » 行业资讯
行业新闻
医疗器械的预期用途、技术要求、安全有效性、有效期等等,很大程度上取决于原材料。
产品注册时确定下来的原材料,轻易不能变化。
但是,企业在实际经营过程中,常常为了降低成本、改善某方面性能、完善供应链、符合升版的标准,或主动、或被动地对原材料进行变更。
材料变更, 质量管理

医疗器械的预期用途、技术要求、安全有效性、有效期等等,很大程度上取决于原材料。
产品注册时确定下来的原材料,轻易不能变化。
但是,企业在实际经营过程中,常常为了降低成本、改善某方面性能、完善供应链、符合升版的标准,或主动、或被动地对原材料进行变更。
材料变更, 质量管理
医疗器械生物相容性评价是确保医疗器械安全性和有效性的重要环节,它涉及到对医疗器械在与人体接触时可能产生的生物学反应和风险的全面评估。根据国家标准GB/T 16886.1-2022《医疗器械生物学评价 第1部分:风险管理过程中的评价与试验》,生物相容性评价应作为医疗器械总体评价和开发过程的一部分,贯穿于产品的全生命周期。
相容性
医疗器械生物相容性评价是确保医疗器械安全性和有效性的重要环节,它涉及到对医疗器械在与人体接触时可能产生的生物学反应和风险的全面评估。根据国家标准GB/T 16886.1-2022《医疗器械生物学评价 第1部分:风险管理过程中的评价与试验》,生物相容性评价应作为医疗器械总体评价和开发过程的一部分,贯穿于产品的全生命周期。
相容性
医疗器械生产组织的质量管理体系需满足四方面要求,即质量管理体系GB/T42061标准要求、法规要求、顾客要求和组织自身要求。
质量体系

医疗器械生产组织的质量管理体系需满足四方面要求,即质量管理体系GB/T42061标准要求、法规要求、顾客要求和组织自身要求。
质量体系
GB9706.1-2020《医用电气设备 第1部分:基本安全和基本性能的通用要求》已经从2023年5月1日起开始实施。那么,企业在执行GB9706系列标准时经常遇到哪些问题?久顺收集汇总不少企业相关询问,本期一并解答。
标准

GB9706.1-2020《医用电气设备 第1部分:基本安全和基本性能的通用要求》已经从2023年5月1日起开始实施。那么,企业在执行GB9706系列标准时经常遇到哪些问题?久顺收集汇总不少企业相关询问,本期一并解答。
标准

行业新闻
在用医疗器械质量检测的常见方法多种多样,这些方法旨在确保医疗器械的安全性、有效性和符合相关标准。以下是一些主要的检测方法:
质量检测

在用医疗器械质量检测的常见方法多种多样,这些方法旨在确保医疗器械的安全性、有效性和符合相关标准。以下是一些主要的检测方法:
质量检测

根据法规要求,医疗器械的说明书、标签应当标示医疗器械生产日期及使用期限(或失效日期),即标示 “生产日期 + 使用期限” 或 “生产日期 + 失效日期”。
失效期, 有效期, 界定

根据法规要求,医疗器械的说明书、标签应当标示医疗器械生产日期及使用期限(或失效日期),即标示 “生产日期 + 使用期限” 或 “生产日期 + 失效日期”。
失效期, 有效期, 界定
本篇内容为学习总结,源自审评二部陈敏老师关于《有源医疗器械注册申报资料要求及常见问题介绍》在器审中心学习云课程的视频。陈老师主要介绍了共性问题、研究资料-联合使用、研究资料-生物学特性、研究资料-清洁、消毒、灭菌、稳定性和92个技术审评共性问题等六个方面。
有源医疗器械, 评审
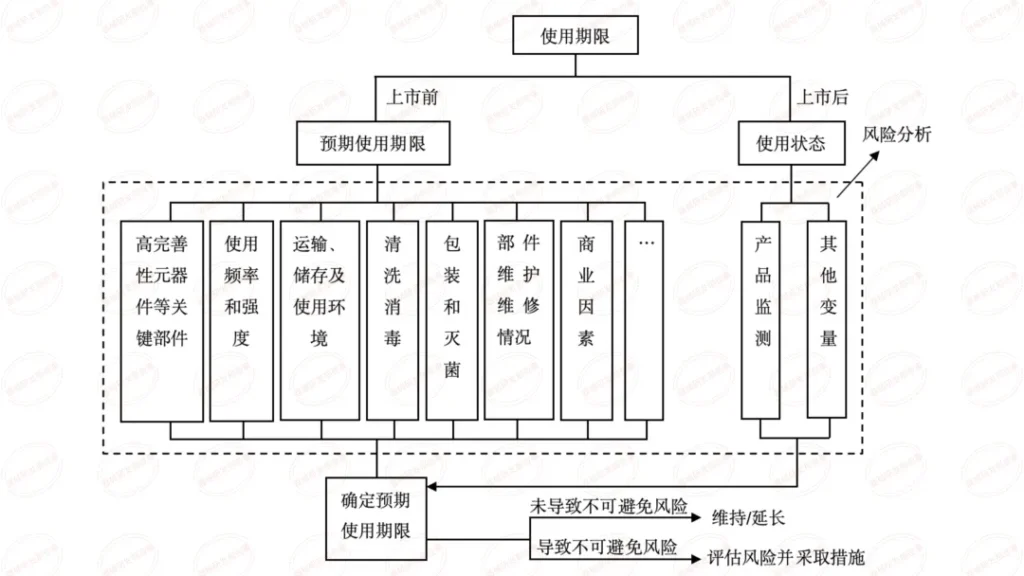
本篇内容为学习总结,源自审评二部陈敏老师关于《有源医疗器械注册申报资料要求及常见问题介绍》在器审中心学习云课程的视频。陈老师主要介绍了共性问题、研究资料-联合使用、研究资料-生物学特性、研究资料-清洁、消毒、灭菌、稳定性和92个技术审评共性问题等六个方面。
有源医疗器械, 评审