首页 » 行业资讯
行业新闻
在医疗器械行业,产品的安全性和合规性一直是至关重要的问题。在上海医疗测试仪器展上,这一点尤其受到关注。为了确保医疗器械在临床使用中能够安全可靠地发挥作用,医疗器械测试是必不可少的步骤。
安全合规, 测试项目清单

在医疗器械行业,产品的安全性和合规性一直是至关重要的问题。在上海医疗测试仪器展上,这一点尤其受到关注。为了确保医疗器械在临床使用中能够安全可靠地发挥作用,医疗器械测试是必不可少的步骤。
安全合规, 测试项目清单


磁兼容性(EMC)是衡量电子设备在电磁环境中正常工作且不对该环境中任何事物构成不能承受的电磁骚扰的能力。对于医疗器械而言,由于其直接应用于人体,对EMC的要求更为严格。
医疗器械EMC
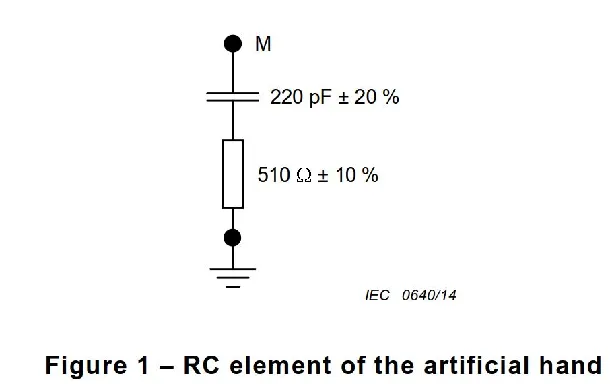
磁兼容性(EMC)是衡量电子设备在电磁环境中正常工作且不对该环境中任何事物构成不能承受的电磁骚扰的能力。对于医疗器械而言,由于其直接应用于人体,对EMC的要求更为严格。
医疗器械EMC
《新版GMP附录1:无菌药品》中无菌药品的定义为:无菌药品是指法定药品标准中列有无菌检查项目的制剂和原料药,一般包括注射剂、无菌原料药、眼用制剂、无菌软膏剂、无菌混悬剂等。药品的无菌保证取决于合理且经过验证的灭菌工艺过程、良好的无菌保证体系以及生产过程中严格的GMP管理。
压力监测, 无菌, 过滤器

《新版GMP附录1:无菌药品》中无菌药品的定义为:无菌药品是指法定药品标准中列有无菌检查项目的制剂和原料药,一般包括注射剂、无菌原料药、眼用制剂、无菌软膏剂、无菌混悬剂等。药品的无菌保证取决于合理且经过验证的灭菌工艺过程、良好的无菌保证体系以及生产过程中严格的GMP管理。
压力监测, 无菌, 过滤器
行业新闻
基于新医改的背景下,针对医疗计量设备的管理,是一项非常有意义的工作。作为医疗计量设备质量管理的关键步骤,医院医疗设备的计量管理工作的重要性和科学性越来越凸显。
计量管理

基于新医改的背景下,针对医疗计量设备的管理,是一项非常有意义的工作。作为医疗计量设备质量管理的关键步骤,医院医疗设备的计量管理工作的重要性和科学性越来越凸显。
计量管理

在医疗领域,器械的精准度至关重要。为了确保医疗器械的性能稳定、准确可靠,定期的校准工作必不可少。然而,在校准过程中,往往存在一些常见的误区和陷阱,可能导致校准结果失真,进而影响医疗质量和患者安全。本文旨在分析这些误区,并提供相应的避免策略。
校准, 陷阱

在医疗领域,器械的精准度至关重要。为了确保医疗器械的性能稳定、准确可靠,定期的校准工作必不可少。然而,在校准过程中,往往存在一些常见的误区和陷阱,可能导致校准结果失真,进而影响医疗质量和患者安全。本文旨在分析这些误区,并提供相应的避免策略。
校准, 陷阱
在医疗行业中,医疗器械的准确性和可靠性对于确保患者的安全和治疗效果至关重要。为了确保医疗器械的性能始终符合预期标准,定期的校准工作是必不可少的。本文将探讨医疗器械校准过程中常见的几个问题及其解决方案,以帮助相关人员更好地进行校准操作。
校准, 解决方案

在医疗行业中,医疗器械的准确性和可靠性对于确保患者的安全和治疗效果至关重要。为了确保医疗器械的性能始终符合预期标准,定期的校准工作是必不可少的。本文将探讨医疗器械校准过程中常见的几个问题及其解决方案,以帮助相关人员更好地进行校准操作。
校准, 解决方案







