上海医疗检测设备展|医疗器械工艺用水验证

通过对工艺用水系统的全面验证,确保该系统能够连续稳定地供应满足生产需求的水量,并证明制水过程能够在长期内持续制备出符合《医疗器械生产质量管理规范-无菌医疗器械实施细则》要求的工艺用水。
医疗质量检测技术及测试仪器展|验证与确认:医疗器械领域的深入解析与实例
在医疗器械行业,验证(Verification)与确认(Validation)不仅仅是质量管理的基本要素,更是确保产品安全、有效性的关键步骤。在医疗质量检测技术及测试仪器展上,这些关键步骤得到了特别的关注和展示。
医疗质量检测技术及测试仪器展|洁净室验证管理规范

本规范基于《医药工业洁净厂房设计规范》,进一步细化了医疗器械生产洁净室的验证管理要求,特别是设计计划(DQ)、安装验证(IQ)、运行验证(OQ)和性能验证(PQ)四个关键阶段,以确保洁净室的设计、建设、运行均符合GMP及国家相关标准,保障医疗器械的生产质量和安全性。
医疗质量检测技术展|无菌封管机验证指导

从缓冲液和培养基的准备、细胞培养操作、纯化操作到最终配方、过滤和转移,无菌断开是制造过程中的关键要素。
医疗质量检测技术及测试仪器展|如何进行立式灭菌锅验证

立式灭菌锅多用于QC实验室,主要用于部件、培养基等的灭菌。
今天主要聊下常见的一些测试项目。
医疗质量检测技术展|封口机验证——灭菌呼吸袋的封边完整性测试

无菌屏障系统的保护功能,是基于其完整性良好,所以完整性就成为无菌屏障系统性能指标的一项重要要求。
医疗器械行业展览丨医疗器械设计验证中的稳定性测试:关键要素与实践
医疗器械的安全性和有效性是医疗健康领域的核心关注点。设计验证是确保医疗器械满足预期使用要求的关键步骤,而稳定性测试则是设计验证中的重要组成部分。本文旨在分享稳定性测试的重点方面,以及如何在实际工作中进行有效实施。
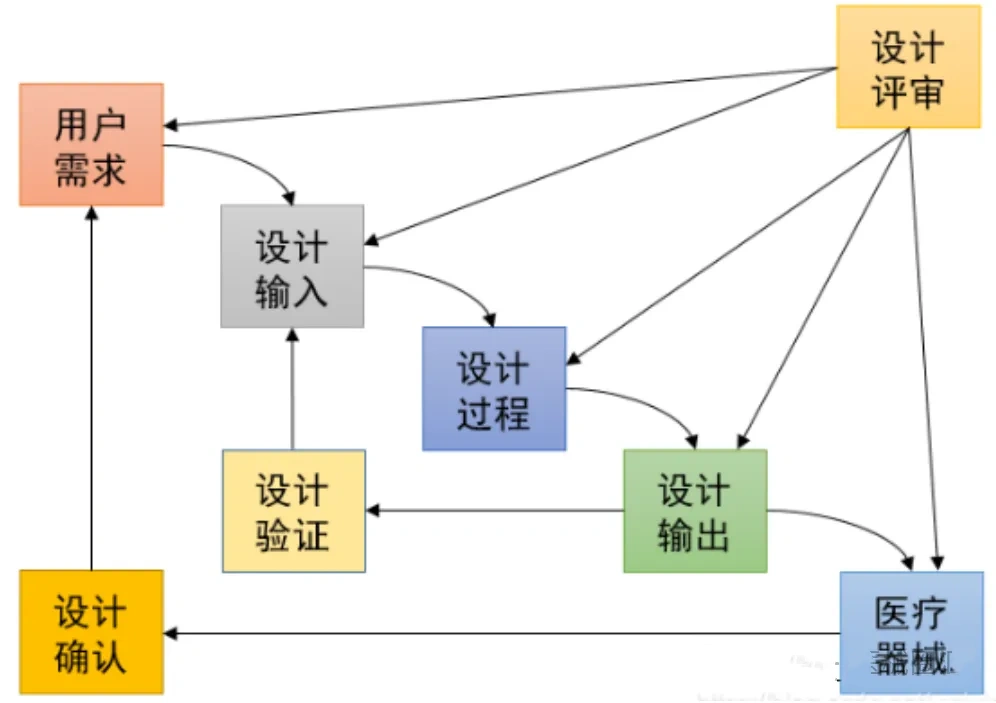
Quality Expo |【原创】浅谈医疗器械的验证(Verification)与确认(Validation) (上)
验证(Verification)与确认(Validation) 就是俗称的V&V。此内容在制药行业非常常见。随着医疗器械行业的发展,这多年也逐渐兴起,慢慢被重视起来设计验证,设计确认,及过程验证,过程确认,软件验证,软件确认。作为专业的质量人员,谈起质量控制,不控制过程,谈产品质量怎么都让人感觉有点虚吧?即使医疗器械行业圈内人士,也经常将两者搞混,可见,二者确实不容易掌握,是行业专业知识技术的一大难点。笔者结合自身多年来在医疗器械行业的学习、实践和感悟,尝试浅谈在医疗器械行业的V&V,供医疗器械从业者们学习,借鉴,分享。
医疗质量检测技术及测试仪器展|浅谈有源医疗器械技术审评关注点
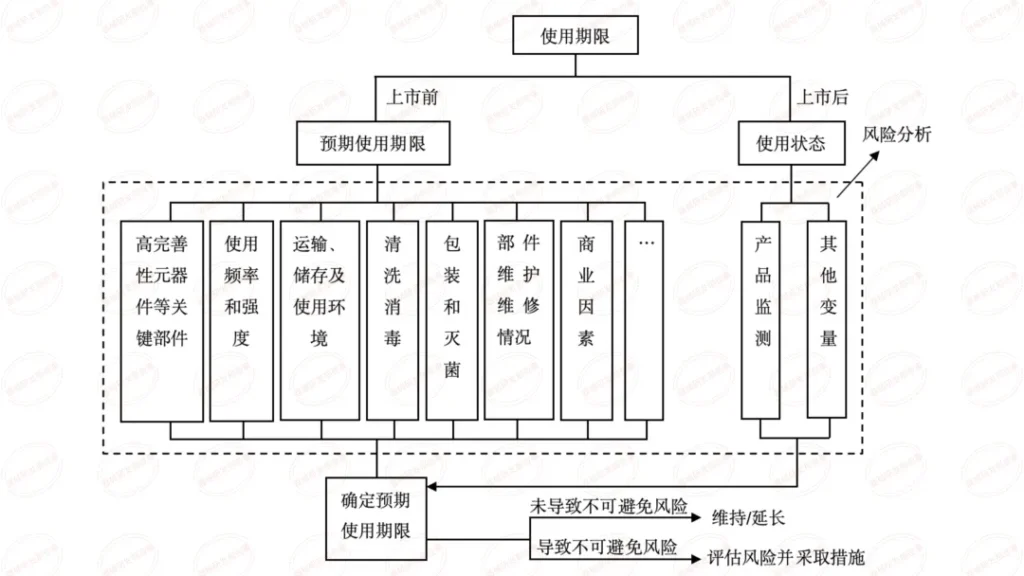
本篇内容为学习总结,源自审评二部陈敏老师关于《有源医疗器械注册申报资料要求及常见问题介绍》在器审中心学习云课程的视频。陈老师主要介绍了共性问题、研究资料-联合使用、研究资料-生物学特性、研究资料-清洁、消毒、灭菌、稳定性和92个技术审评共性问题等六个方面。
医疗质量检测技术展|你真的了解高压蒸汽灭菌器吗?
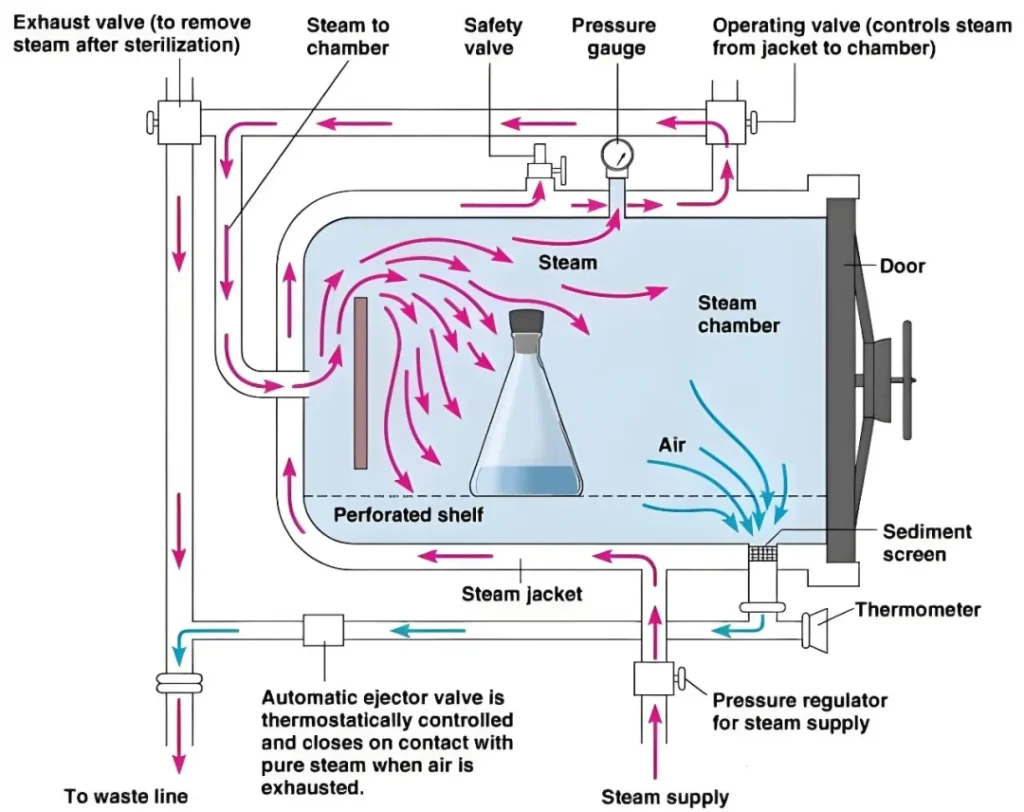
高压灭菌器是一种常用的灭菌设备,采用电热丝加热。当水加热到一定温度时,水就会变成蒸汽。






