医疗质量检测技术及测试仪器展|医疗器械独立软件核查中对相关标准的思考
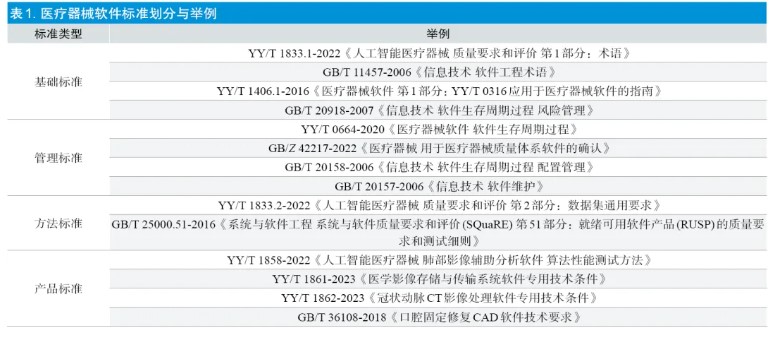
随着计算机技术的进步,医疗器械软件行业正处于高速发展期。近年来,上海市独立软件产品申报数量大幅增长。相较于其他医疗器械产品,软件产品的多样化程度高、技术发展迅速、产品迭代更新快、非实体导致缺陷隐蔽性强,因此产品的安全有效性评价难度较高。在审评核查的过程中发现,医疗器械软件产品常见基本概念不清晰、性能指标和检验方法不明确、产品验证与确认不充分、生存周期过程控制不足等问题。标准在规范产品性能指标、保证产品安全有效性、促进创新和技术进步等方面发挥着重要的作用。随着医疗器械软件行业的迅速发展以及产品自身的复杂性,对配套标准也提出了更高的要求。本文在概要论述医疗器械软件标准发展现状的基础上,分析了目前在医疗器械独立软件审评核查中与标准相关的常见问题,探讨了如何更加有效地开展医疗器械软件质量评价工作,并提出了软件标准未来发展的若干思考和建议,以期加强标准的指导意义、统一评价尺度、促进医疗器械软件的标准化进程。
医疗质量检测技术展|医疗器械软件出厂检是不是不需要功能检验?
按照《医疗器械生产企业质量控制与成品放行指南》的相关要求,成品检验规程的内容原则上应当覆盖已注册或者备案的产品技术要求中需要常规控制的检验项目和检验方法。对于带软件组件的产品或独立软件,在技术要求中会列出部分软件功能。在设计开发阶段,独立软件已完成功能性能的系统测试验证。在生产阶段基本是一个软件组件的部署或者是独立软件交付物的拷贝过程,在出厂检验中是否可以不对软件功能进行再次测试?
医疗质量检测技术展|医疗器械软件注册检验要点及方法研究
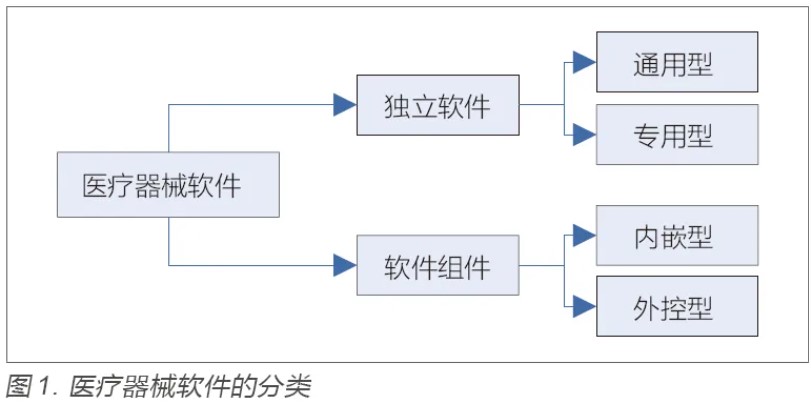
目的:针对医疗器械软件注册检验要点和检测方法进行研究,为加强医疗器械软件的质量保证工作提供参考。方法:以医疗器械软件注册指导原则为基础,梳理不同医疗器械软件的特点和分类,明确软件产品技术要求的编制指南,并且结合通用要求、质量要求、专用要求、安全要求四个方面的要求,对注册检验内容进行解读,最后总结常用检测方法和检测工具。结果:梳理的医疗器械软件注册检验要点可以为注册申请人编写产品技术要求提供指导,总结的检验方法和检测工具可以给检测机构开展相关评测提供借鉴。结论:医疗器械软件检验应从通用要求、质量要求、专用要求和安全要求四个方面进行,检测主要涉及功能测试和性能测试两大类,性能测试通常需借助专业工具进行。
上海医疗测试仪器展|医疗器械的有效期、失效期和使用期的界定

根据法规要求,医疗器械的说明书、标签应当标示医疗器械生产日期及使用期限(或失效日期),即标示 “生产日期 + 使用期限” 或 “生产日期 + 失效日期”。
医疗质量检测技术及测试仪器展|浅谈有源医疗器械技术审评关注点
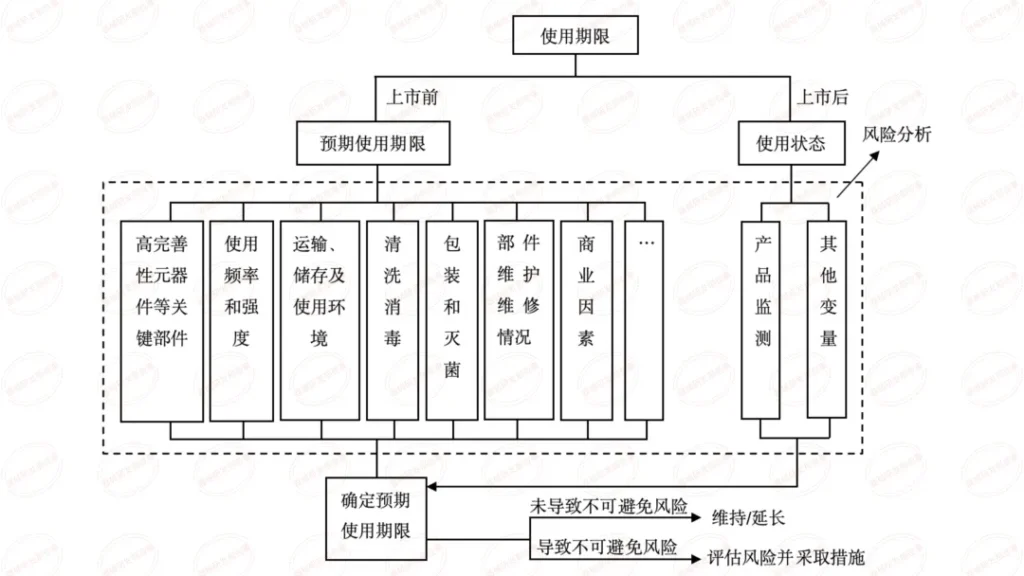
本篇内容为学习总结,源自审评二部陈敏老师关于《有源医疗器械注册申报资料要求及常见问题介绍》在器审中心学习云课程的视频。陈老师主要介绍了共性问题、研究资料-联合使用、研究资料-生物学特性、研究资料-清洁、消毒、灭菌、稳定性和92个技术审评共性问题等六个方面。
上海医疗检测设备展|医疗器械工艺用水验证

通过对工艺用水系统的全面验证,确保该系统能够连续稳定地供应满足生产需求的水量,并证明制水过程能够在长期内持续制备出符合《医疗器械生产质量管理规范-无菌医疗器械实施细则》要求的工艺用水。
医疗质量检测技术及测试仪器展|验证与确认:医疗器械领域的深入解析与实例
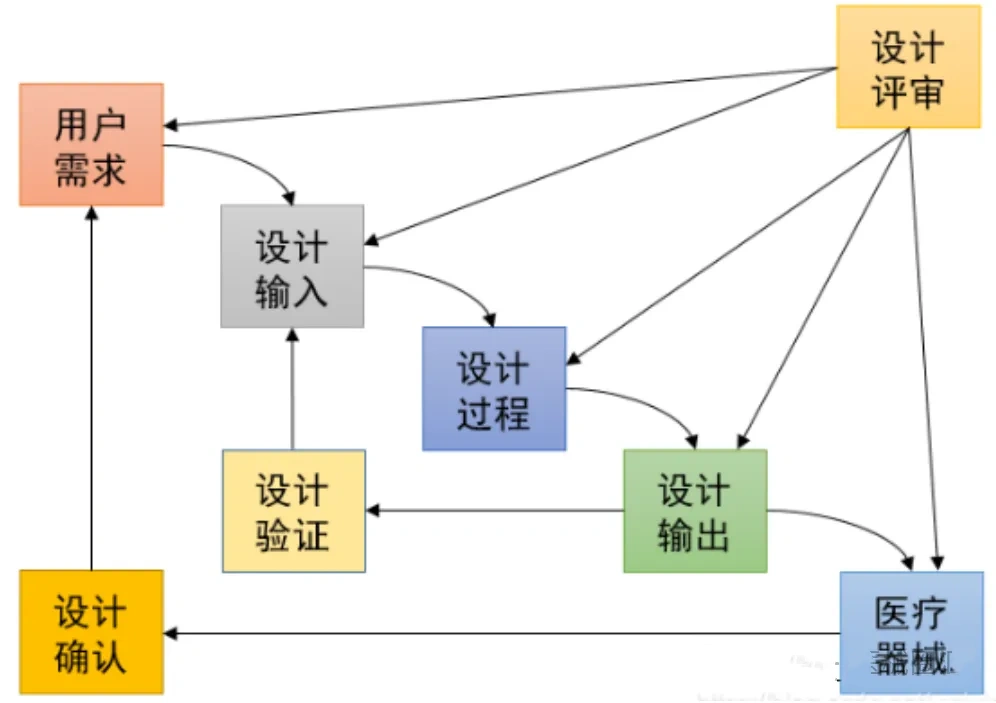
在医疗器械行业,验证(Verification)与确认(Validation)不仅仅是质量管理的基本要素,更是确保产品安全、有效性的关键步骤。在医疗质量检测技术及测试仪器展上,这些关键步骤得到了特别的关注和展示。
上海医疗检测设备展|ISO13485和GB/T42061解读、导入与审核(条款7.3.3 设计和开发输入)
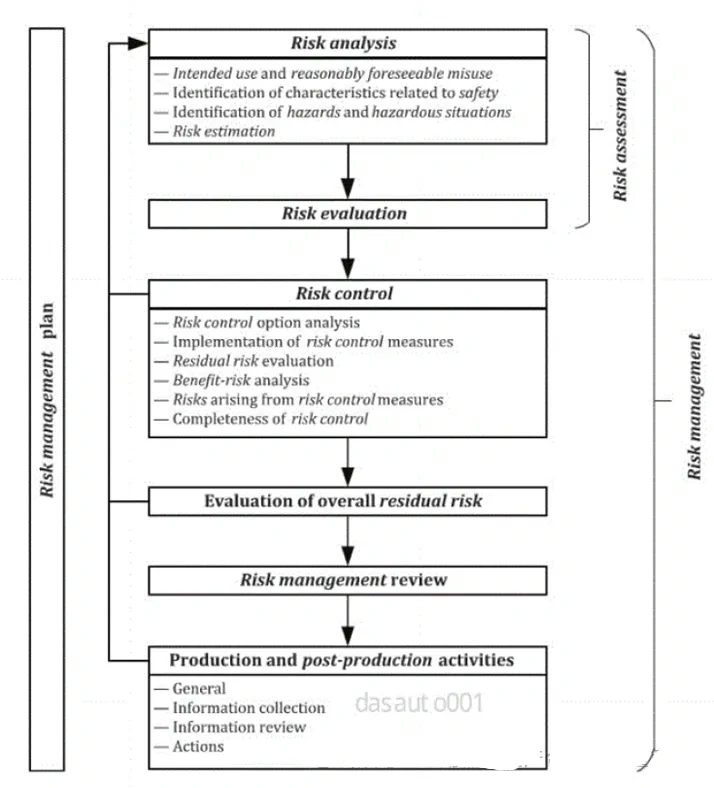
ISO13485:2016《医疗器械质量管理体系用于法规的要求》,由ISO国际标准化组织于2016年3月1 日正式发布,是一项应用于医疗器械领域的质量管理体系的国际标准,强调医疗器械的安全有效,组织提供的医疗器械要满足顾客和法规要求。
医疗质量检测技术展|中国GMP医疗器械生产质量管理规范包含哪些?
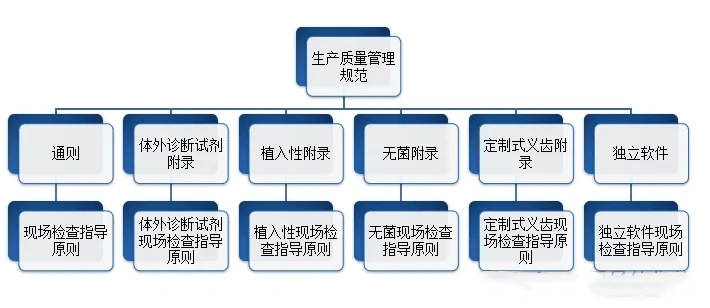
生产企业应当按照医疗器械生产质量管理规范的要求,结合产品特点,建立健全与所生产医疗器械相适应的质量管理体系,并保证其有效运行。在医疗质量检测技术展上,这些生产企业将有机会展示他们如何遵循这些规范,并通过先进的质量管理系统确保其产品的高标准和可靠性。
上海医疗测试仪器展|2024年最新有源医疗器械风险管理的流程
有源医疗器械在医疗领域中扮演着至关重要的角色,而风险管理则是确保其安全、有效和质量可控的关键环节。以下将详细介绍有源医疗器械风险管理的流程。






