医疗质量检测技术展|中国GMP医疗器械生产质量管理规范包含哪些?
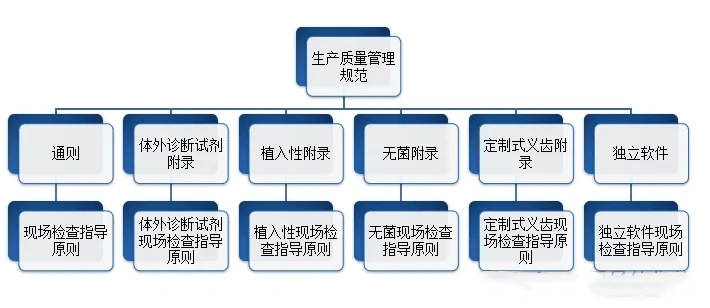
生产企业应当按照医疗器械生产质量管理规范的要求,结合产品特点,建立健全与所生产医疗器械相适应的质量管理体系,并保证其有效运行。在医疗质量检测技术展上,这些生产企业将有机会展示他们如何遵循这些规范,并通过先进的质量管理系统确保其产品的高标准和可靠性。
医疗质量检测技术展|医疗器械生产组织的质量管理体系需满足的四方面要求

医疗器械生产组织的质量管理体系需满足四方面要求,即质量管理体系GB/T42061标准要求、法规要求、顾客要求和组织自身要求。
医疗质量检测技术展|医疗器械注册质量管理体系核查指南介绍

本指南旨在加强医疗器械注册质量管理体系的核查管理,确保核查工作的质量。依据包括《医疗器械监督管理条例》、《医疗器械注册与备案管理办法》、《体外诊断试剂注册与备案管理办法》、《医疗器械生产监督管理办法》、《医疗器械生产质量管理规范》、《医疗器械临床试验质量管理规范》及《医疗器械注册自检管理规定》等法规。
上海医疗测试仪器展|ISO13485医疗器械质量管理标准 问与答 (一)

医疗器械质量管理体系起源于2000年我国发布的第22号医疗器械质量管理体系核查要求,并在此基础上历经九年发展形成了我国第一版医疗器械生产质量管理规范。随着医疗器械行业的快速发展,我国于2014年对GMP进行了修正并形成了最新的标准规范。同时,其他国家和地区也陆续建立了相应的质量管理体系标准法规,例如美国的CDMP及后续QSF20法规,欧盟的ENISO13485标准及其多次修订等。在70年代,美国率先制定了CDMP法规,并在其基础上于1996年发布针对质量管理体系要求的QSF20法规。欧盟则从1993年开始酝酿并报告了EN1N46001标准法规,但后来对该标准进行了修订和完善。国际标准化组织在1996年发布了基于ISO9001系列的两个医疗器械质量管理体系标准,即ISO13485:1996版与ISO13481:1996版,并随9001版本升级不断调整优化,最终在2016年发布了全新的ISO13485:2016版标准。
医疗质量检测技术及测试仪器展|质量管理体系构建中,值得避坑的案例学习!

近期国家药监局在对部分医疗器械企业进行飞检过程中,发现部分企业的质量管理体系存在较大缺陷,本次笔者就针对飞检的2家企业的问题进行收集整理,希望对各企业在质量管理体系的管理中有所借鉴和帮助。
医疗器械制造展丨设计变更的质量管理实践

设计变更是一个关键的医疗器械质量管理体系中的环节,需要我们采取适当的步骤,确保变更的安全性、有效性以及符合法规要求。结合以往实战经验,提供以下是一些实施建议,期望可以帮助我们在设计变更活动中做得更好:
上海医疗测试仪器展|ISO13485医疗器械质量管理体系认证清单

ISO13485医疗器械质量管理体系认证流程
上海医疗检测设备展|通过医疗设备制造中的质量管理降低风险
FDA(美国食品和药物管理局)第一级召回或医疗器械公司自愿召回的例子并不鲜见。2019年,美敦力公司(Medtronic)被迫召回1000多台MiniMed胰岛素泵,原因是产品存在网络安全风险,黑客可以遥控操作这些泵。糖尿病患者用胰岛素泵来自我管理胰岛素水平,水平高低关于患者生命健康。
医疗质量检测技术及测试仪器展|浅谈有源医疗器械技术审评关注点
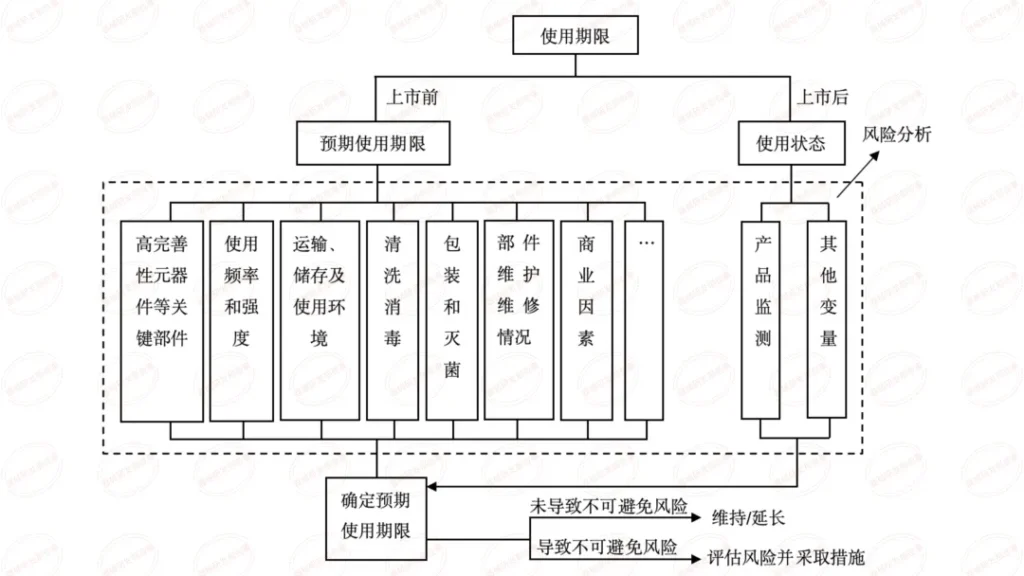
本篇内容为学习总结,源自审评二部陈敏老师关于《有源医疗器械注册申报资料要求及常见问题介绍》在器审中心学习云课程的视频。陈老师主要介绍了共性问题、研究资料-联合使用、研究资料-生物学特性、研究资料-清洁、消毒、灭菌、稳定性和92个技术审评共性问题等六个方面。
上海医疗检测设备展|医疗器械工艺用水验证

通过对工艺用水系统的全面验证,确保该系统能够连续稳定地供应满足生产需求的水量,并证明制水过程能够在长期内持续制备出符合《医疗器械生产质量管理规范-无菌医疗器械实施细则》要求的工艺用水。






