医疗质量检测技术展|医疗器械必学法规:医疗器械使用质量监督管理办法(国家食药监管理总局令第18号)

这份法规文件主要规定了医疗器械在使用环节的质量管理要求和监督管理措施,旨在确保医疗器械的使用安全、有效。以下是文件中的关键知识点:
医疗质量检测技术及测试仪器展|浅谈有源医疗器械技术审评关注点
本篇内容为学习总结,源自审评二部陈敏老师关于《有源医疗器械注册申报资料要求及常见问题介绍》在器审中心学习云课程的视频。陈老师主要介绍了共性问题、研究资料-联合使用、研究资料-生物学特性、研究资料-清洁、消毒、灭菌、稳定性和92个技术审评共性问题等六个方面。
上海医疗检测设备展|ISO13485和GB/T42061解读、导入与审核(条款7.3.3 设计和开发输入)
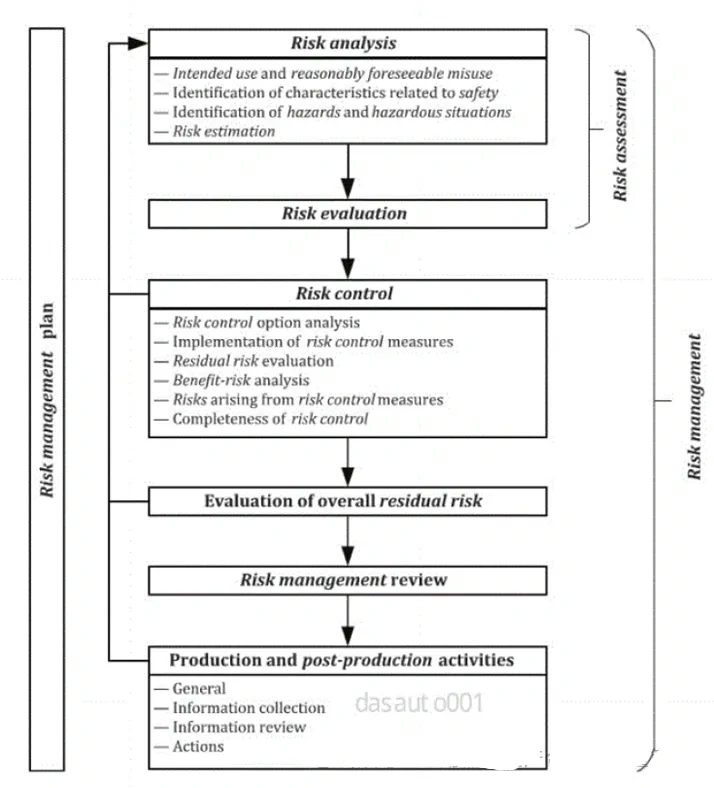
ISO13485:2016《医疗器械质量管理体系用于法规的要求》,由ISO国际标准化组织于2016年3月1 日正式发布,是一项应用于医疗器械领域的质量管理体系的国际标准,强调医疗器械的安全有效,组织提供的医疗器械要满足顾客和法规要求。
医疗质量检测技术展|关于国内医疗器械不同类型的检验报告,你知道有哪些吗?

众所周知,工厂生产工业品,都要经过检验合格之后才能上市销售。特别是食品、药品、医疗器械等与人们健康息息相关的产品,检验标准尤为严格。国家药监局2019年8月发布了《国家药监局关于印发医疗器械检验工作规范的通知》,进一步规范医疗器械检验工作。
医疗质量检测技术及测试仪器展|医疗器械GMP要升级

2014年12月,原国家食品药品监督管理总局(CFDA)发布了医疗器械生产质量管理规范(以下简称医疗器械GMP)(2014年第64号),并随后陆续推出了无菌医疗器械、植入性医疗器械、体外诊断试剂、定制式义齿和独立软件(注:NMPA发布)等5个附录。
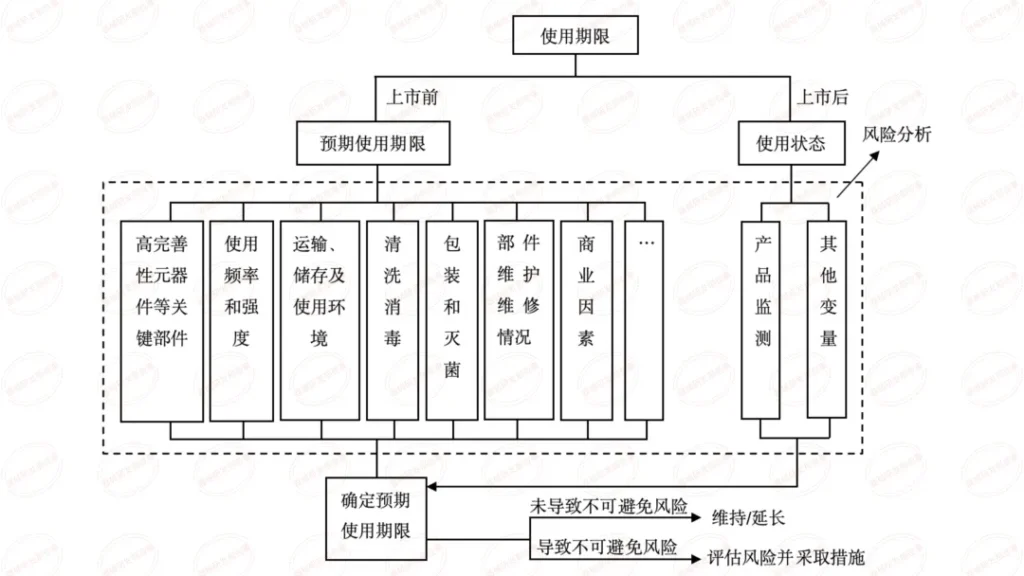
医疗质量检测技术展|医疗器械原材料变更的基本流程

医疗器械的预期用途、技术要求、安全有效性、有效期等等,很大程度上取决于原材料。
产品注册时确定下来的原材料,轻易不能变化。
但是,企业在实际经营过程中,常常为了降低成本、改善某方面性能、完善供应链、符合升版的标准,或主动、或被动地对原材料进行变更。
医疗质量检测技术及测试仪器展|读懂GB9706医疗器械强制标准,离不开这5大问题!

GB9706.1-2020《医用电气设备 第1部分:基本安全和基本性能的通用要求》已经从2023年5月1日起开始实施。那么,企业在执行GB9706系列标准时经常遇到哪些问题?久顺收集汇总不少企业相关询问,本期一并解答。
医疗质量检测技术展|医疗器械注册检验常见问题答疑汇总

A:维氏硬度检测不需要提供单独的试样,在送检样品上取样测试;洛氏硬度检测若被测部位形状不规则时,无法直接对样品进行测试,应提供原材料试样块,并提供材质、热处理工艺一致性声明。
医疗质量检测技术展|医疗器械“体考”到底是什么?

《医疗器械生产监督管理办法》明确规定:医疗器械生产企业应当按照医疗器械生产质量管理规范的要求,建立质量管理体系并保持有效运行。申请人在申请产品注册时,受理注册申请的药品监督管理部门在产品技术审评时,认为有必要对质量管理体系进行核查的,会组织开展质量管理体系核查。
医疗质量检测技术展|医疗器械注册质量管理体系核查指南介绍

本指南旨在加强医疗器械注册质量管理体系的核查管理,确保核查工作的质量。依据包括《医疗器械监督管理条例》、《医疗器械注册与备案管理办法》、《体外诊断试剂注册与备案管理办法》、《医疗器械生产监督管理办法》、《医疗器械生产质量管理规范》、《医疗器械临床试验质量管理规范》及《医疗器械注册自检管理规定》等法规。






