医疗质量检测技术及测试仪器展|浅谈有源医疗器械技术审评关注点
本篇内容为学习总结,源自审评二部陈敏老师关于《有源医疗器械注册申报资料要求及常见问题介绍》在器审中心学习云课程的视频。陈老师主要介绍了共性问题、研究资料-联合使用、研究资料-生物学特性、研究资料-清洁、消毒、灭菌、稳定性和92个技术审评共性问题等六个方面。
上海医疗测试仪器展|2024年最新有源医疗器械风险管理的流程
有源医疗器械在医疗领域中扮演着至关重要的角色,而风险管理则是确保其安全、有效和质量可控的关键环节。以下将详细介绍有源医疗器械风险管理的流程。
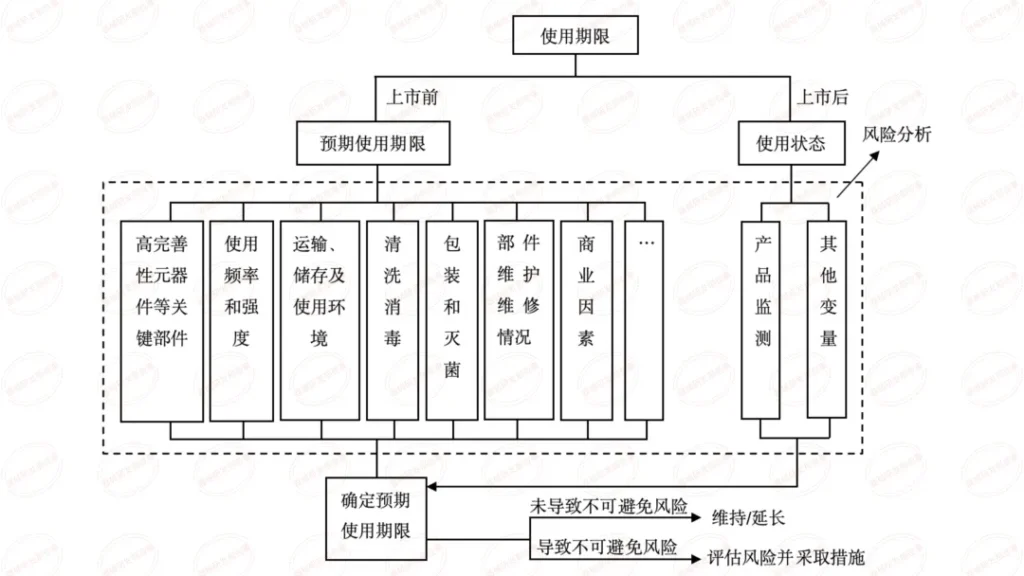
医疗质量检测技术展|有源医疗器械使用期限研究资料在注册过程的常见问题
部分申请人在选择直接评价路径时,未对器械的临床应用场景和使用状态进行详细分析,未根据器械结构特点和生产实际设计验证方案。如:低温储存设备、电动病床、洁净工作台等器械结构简单、体型较大,直接对设备整体进行加速试验需要配备大型的恒温恒湿老化试验箱,既增大了试验成本,也给企业自身带来负担,且这类器械主体结构为金属材质,在器械使用期限内较为稳定,不会因失效而产生使用风险。
上海医疗测试仪器展|医疗器械的有效期、失效期和使用期的界定

根据法规要求,医疗器械的说明书、标签应当标示医疗器械生产日期及使用期限(或失效日期),即标示 “生产日期 + 使用期限” 或 “生产日期 + 失效日期”。
医疗质量检测技术展|医疗器械软件出厂检是不是不需要功能检验?
按照《医疗器械生产企业质量控制与成品放行指南》的相关要求,成品检验规程的内容原则上应当覆盖已注册或者备案的产品技术要求中需要常规控制的检验项目和检验方法。对于带软件组件的产品或独立软件,在技术要求中会列出部分软件功能。在设计开发阶段,独立软件已完成功能性能的系统测试验证。在生产阶段基本是一个软件组件的部署或者是独立软件交付物的拷贝过程,在出厂检验中是否可以不对软件功能进行再次测试?
医疗质量检测技术及测试仪器展|读懂GB9706医疗器械强制标准,离不开这5大问题!

GB9706.1-2020《医用电气设备 第1部分:基本安全和基本性能的通用要求》已经从2023年5月1日起开始实施。那么,企业在执行GB9706系列标准时经常遇到哪些问题?久顺收集汇总不少企业相关询问,本期一并解答。
医疗质量检测技术及测试仪器展|医疗器械GMP:检验设备是否都需要校验

企业生产医疗器械时,为确认产品性能指标以及生产和检验环境的洁净度,需要对产品性能指标、洁净区环境、工艺用水、产品无菌性能、环氧乙烷残留量(EO灭菌)等进行检验。质量检验的结果是否准确可靠,取决于检验设备测量的结果的准确性,企业在使用检验设备时,需要提供客观证据,证明设备符合要求。
医疗质量检测技术展|医疗器械注册检验常见问题答疑汇总

A:维氏硬度检测不需要提供单独的试样,在送检样品上取样测试;洛氏硬度检测若被测部位形状不规则时,无法直接对样品进行测试,应提供原材料试样块,并提供材质、热处理工艺一致性声明。
上海医疗检测设备展|了解医用电气设备安规测试仪需要从哪些方面进行?
TOS9300系列是一款高性能安规试验仪,可帮助您执行符合各种标准的医用电气设备的安规测试。此系列涵盖高压绝缘耐压测试,绝缘电阻,接地阻抗,泄漏电流(接触电流和保护导体电流)以及局部放电测试。该多功能测试仪提高了生产效率并节约了宝贵的生产空间,是研发,质量保证,生产线和实验室的理想选择。
医疗器械行业展览丨医疗器械摸底测试

医疗器械摸底测试是在医疗器械开发的早期阶段进行的初步测试,旨在了解医疗器械的基本性能和特征,初步评估其适应性和可行性,防止在医疗器械注册检验过程中耽误更多的时间,延缓上市周期。






