医疗质量检测技术展|医疗仪器校准证书有效期是怎样进行规定的?多久校准一次?
医疗机构对于仪器管理都比较重视,一般还会成立专门的品管部,每到一定时间就会对机构内的仪器进行检测维护,如果不及时进行仪器校准维护,更新相关的医疗仪器校准证书,相关部门的检查就很难通过,并且还会埋藏较大的安全隐患。那么医疗仪器校准证书有效期是怎样进行规定的?多久校准一次?医疗质量检测技术展为您进行详细介绍。
医疗质量检测技术及测试仪器展|医疗器械工艺用水3Q4验证规范与实践

水质污染的核心因素:季节变化(温度、微生物) 农业污染(农药、化肥、无机物) 工业污染(有机物) 生活污染(排泄物、微生物) 市政水消毒(氨与氯的化合物) 用户总进水(施工带来的污染)
医疗质量检测技术及测试仪器展|如何做好医疗设备计量管理?

基于新医改的背景下,针对医疗计量设备的管理,是一项非常有意义的工作。作为医疗计量设备质量管理的关键步骤,医院医疗设备的计量管理工作的重要性和科学性越来越凸显。
上海医疗测试仪器展|校准误区解析:避免医疗器械校准中的常见陷阱

在医疗领域,器械的精准度至关重要。为了确保医疗器械的性能稳定、准确可靠,定期的校准工作必不可少。然而,在校准过程中,往往存在一些常见的误区和陷阱,可能导致校准结果失真,进而影响医疗质量和患者安全。本文旨在分析这些误区,并提供相应的避免策略。
医疗质量检测技术及测试仪器展|浅谈在用医疗器械质量检测的常见方法有哪些

在用医疗器械质量检测的常见方法多种多样,这些方法旨在确保医疗器械的安全性、有效性和符合相关标准。以下是一些主要的检测方法:
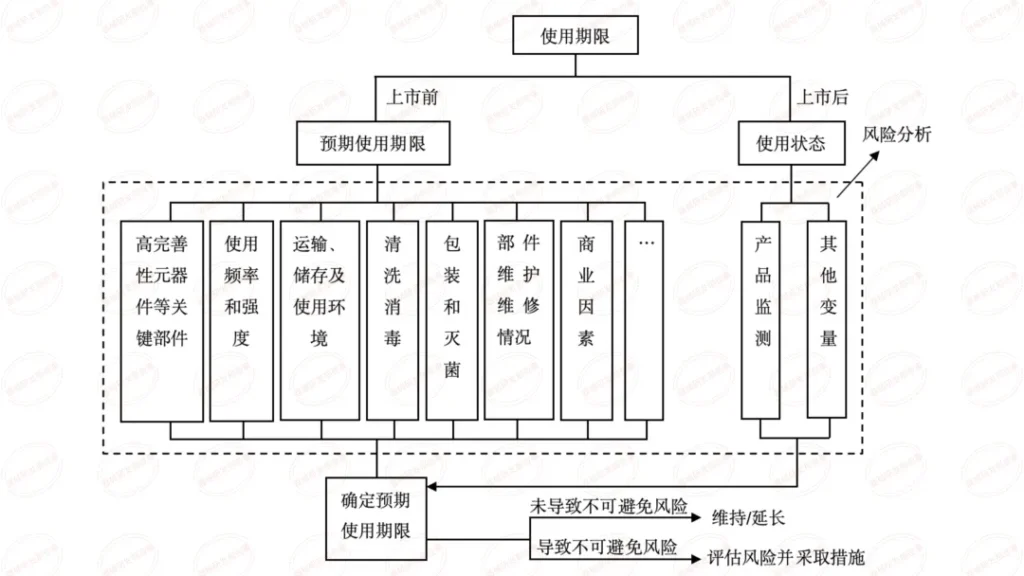
上海医疗测试仪器展|医疗器械的有效期、失效期和使用期的界定

根据法规要求,医疗器械的说明书、标签应当标示医疗器械生产日期及使用期限(或失效日期),即标示 “生产日期 + 使用期限” 或 “生产日期 + 失效日期”。
医疗质量检测技术及测试仪器展|浅谈有源医疗器械技术审评关注点
本篇内容为学习总结,源自审评二部陈敏老师关于《有源医疗器械注册申报资料要求及常见问题介绍》在器审中心学习云课程的视频。陈老师主要介绍了共性问题、研究资料-联合使用、研究资料-生物学特性、研究资料-清洁、消毒、灭菌、稳定性和92个技术审评共性问题等六个方面。
医疗质量检测技术及测试仪器展|验证与确认:医疗器械领域的深入解析与实例
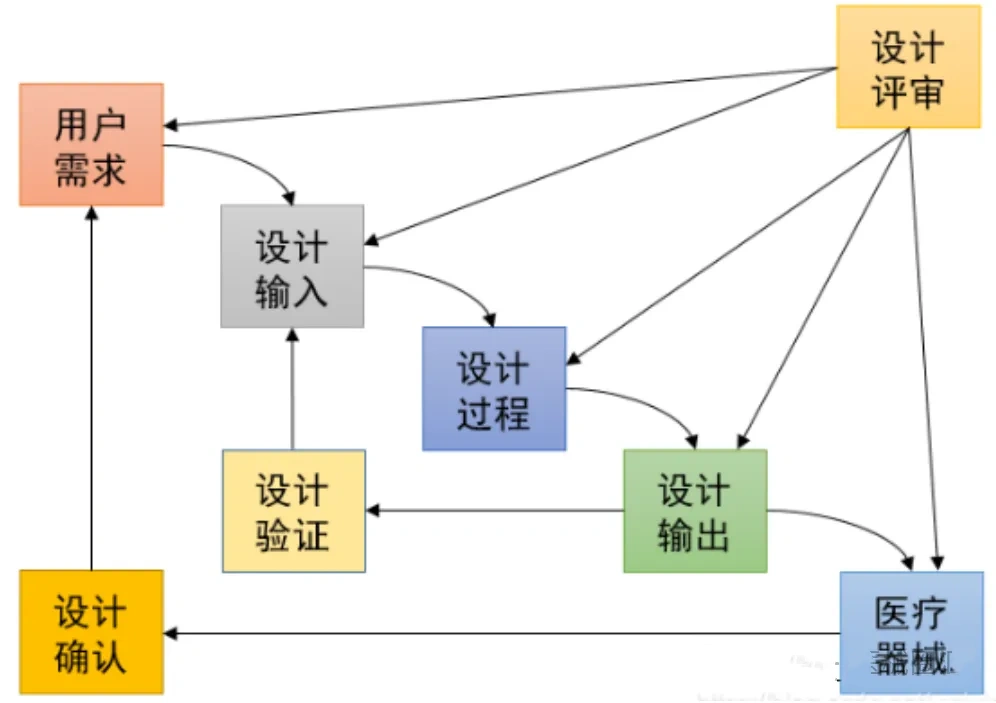
在医疗器械行业,验证(Verification)与确认(Validation)不仅仅是质量管理的基本要素,更是确保产品安全、有效性的关键步骤。在医疗质量检测技术及测试仪器展上,这些关键步骤得到了特别的关注和展示。
上海医疗测试仪器展|医疗器械测试项目清单:确保安全合规的关键步骤

在医疗器械行业,产品的安全性和合规性一直是至关重要的问题。在上海医疗测试仪器展上,这一点尤其受到关注。为了确保医疗器械在临床使用中能够安全可靠地发挥作用,医疗器械测试是必不可少的步骤。
医疗质量检测技术及测试仪器展|医疗器械EMC要求概览 1
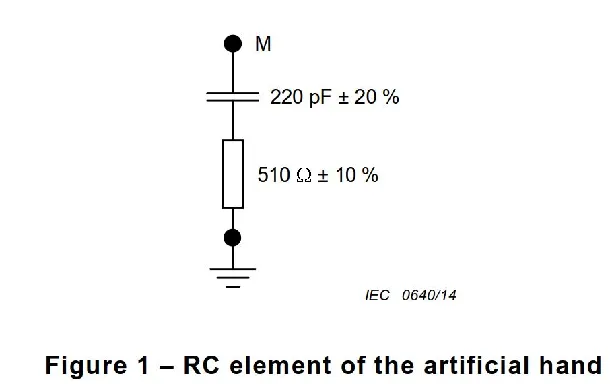
磁兼容性(EMC)是衡量电子设备在电磁环境中正常工作且不对该环境中任何事物构成不能承受的电磁骚扰的能力。对于医疗器械而言,由于其直接应用于人体,对EMC的要求更为严格。






