医疗器械工艺用水验证
目的
通过对工艺用水系统的全面验证,确保该系统能够连续稳定地供应满足生产需求的水量,并证明制水过程能够在长期内持续制备出符合《医疗器械生产质量管理规范-无菌医疗器械实施细则》以及上海医疗检测设备展上展示的最新行业标准要求的工艺用水。
方法
工艺用水系统的验证主要包括以下四个关键阶段:设计鉴定(DQ)、安装鉴定(IQ)、运行鉴定(OQ)和性能鉴定(PQ)。
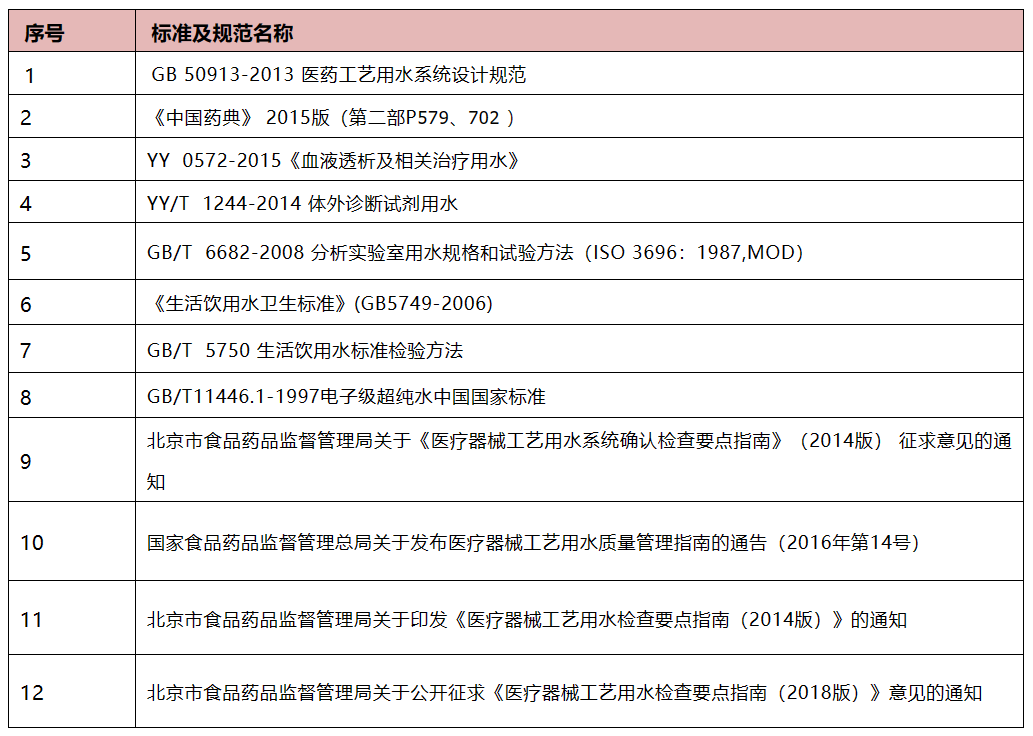
工艺用水的相关标准规范如下:
一般饮用水中都含有:电解质、颗粒、有机物、微生物等杂质。工艺用水就是通物理化学的方法将上述杂质去除达到其对应的要求。常用的工艺用水制备方法及流程如下:
1、常用工艺用水制备方法:

设计鉴定(DQ)
目的
设计确认旨在确保纯化水系统是根据买方的具体需求进行设计的,并且符合相关的设备和系统设计标准。
内容
-
用户需求(URS):明确水的用途、水质要求、水制备工艺的选择以及分配系统的设计要求(如用水量、使用点)等。
-
关键参数设置:如电导率、温度等关键参数的设定需符合生产需求。
-
设计标准:系统流程设计(包括循环泵数量、回路数量等)、设备选型、参数设定、品牌、材质、容积、精度以及控制系统等均需符合设计要求。
安装鉴定(IQ)
目的
安装鉴定旨在确认工艺用水系统的关键性能和管道系统已正确安装,以确保系统能够正常运行。
内容
-
文件资料:收集并审核工艺用水系统的相关图纸、附件资料、设备说明书、部件清单、操作手册等。
-
设备安装确认:对照设计图纸及供应商提供的技术资料,检查安装是否符合设计及规范。包括管路安装调试、材质证明、焊接质量、压力测试、清洗钝化等。
-
控制系统:确认控制系统的硬件已正确安装,软件可正常运行,并进行软件确认(CSV)。
-
仪器仪表确认:确认仪器仪表的清单、安装位置、精度等,并确保关键仪器仪表已校准。
-
公用工程:检查为设备提供服务的配电、压缩空气、进水水压等是否满足要求。
运行鉴定(OQ)
目的
运行鉴定旨在确定工艺用水系统能够按照设定的参数运行,并产生符合标准要求的工艺用水。
内容
-
系统试运行:测试预处理系统、脱盐装置、后处理装置、贮存装置、控制系统和仪器仪表是否能够按照预定的设计参数及上下极限参数正常运行。
-
自动控制系统测试:测试控制面板功能、报警系统的灵敏性等。
-
定时监测:记录监测仪表的数据,确认持续运行时运行参数的正确性和稳定性。
-
关键参数和在线监测项目:确定水系统的关键参数和在线监测项目,如电导率、PH值等。
-
终端使用点时间:确定工艺用水系统开启后终端(使用点)能够正常使用的时间。
-
安全性测试:测试各项报警功能的有效性,模拟实际运行过程中可能遇到的各种情况,特别是电源中断时的安全性。
-
消毒方式确认:确认所选的消毒方式(如巴氏消毒、化学消毒、臭氧消毒、蒸汽消毒)的有效性。
性能鉴定(PQ)
目的
性能鉴定旨在证明在规定的条件下,工艺用水系统能够持续生产出符合要求的合格工艺用水。
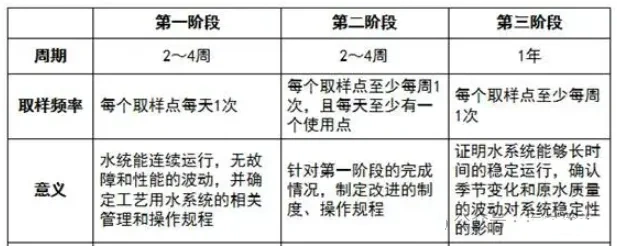
内容
-
持续生产验证:在规定条件下,连续运行工艺用水系统,并监测水质指标,确保水质符合生产需求。
-
稳定性测试:通过长时间运行和监测,评估系统的稳定性和可靠性。
-
记录与分析:详细记录验证过程中的数据,并进行分析,以评估系统的性能是否符合预期。
通过这四个阶段的验证,可以全面评估工艺用水系统的性能和可靠性,确保其为医疗器械生产提供稳定、合格的工艺用水。
文章来源: 医械圈汇
若涉及侵权,请立刻联系删除
关键字:










