Part.03
无菌包装质量控制
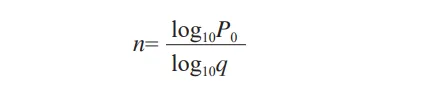
P0——未被发现的风险

确认过程中,除了使用极限参数生产样品进行验证,还要验证不同模具、不同封条对包装的影响。灭菌过程也是影响封口质量的一个因素,灭菌前和灭菌后的封口质量对比也要充分考虑到。还要考虑批量的验证,包括不同人员在不同时间段,生产不同批次的包装产生的差异性。
Part.04
总 结
文章来源: 制药工艺与装备
若涉及侵权,请立刻联系删除
关键字:
Part.03
无菌包装质量控制
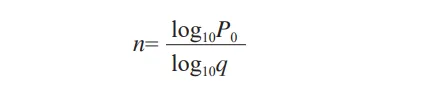
P0——未被发现的风险

确认过程中,除了使用极限参数生产样品进行验证,还要验证不同模具、不同封条对包装的影响。灭菌过程也是影响封口质量的一个因素,灭菌前和灭菌后的封口质量对比也要充分考虑到。还要考虑批量的验证,包括不同人员在不同时间段,生产不同批次的包装产生的差异性。
Part.04
总 结
文章来源: 制药工艺与装备
若涉及侵权,请立刻联系删除
关键字:

关注Medtec公众号
快捷获取更多信息

关注Medtec 服务号
了解高端有源资讯

加Medtec小助手好友
1V1帮您采购
主办方:
主办方:
Copyright © 2025 英富曼企业管理(上海)有限公司 沪ICP备2022023039号-8