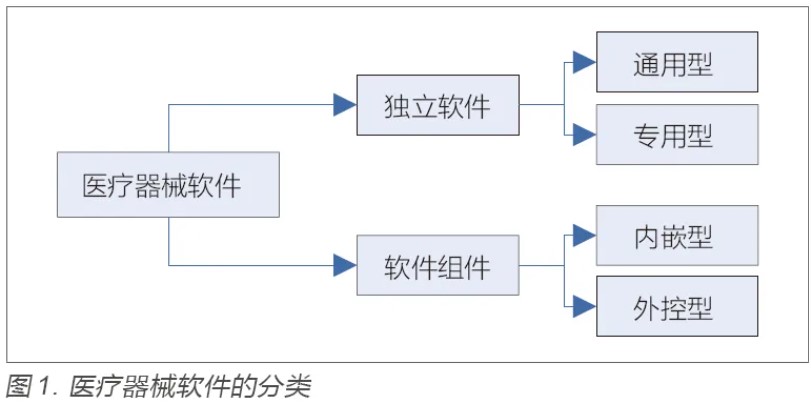
《医疗器械软件注册技术审查指导原则(2022 年修订版)》共列出了15 项通用要求,供大家参考以建立产品技术要求的性能指标。从产品临床使用的角度可以将这15项要求归纳为功能和性能两大方面。其中临床功能、接口、使用限制、输入输出、必备软硬件、消息、用户界面、访问控制和版权保护属于功能方面的要求,运行环境、最大并发数、性能效率、可靠性、用户差错防御和维护性属于性能方面的要求。下面将逐条进行解读。
2.1.1 临床功能。需要依据产品说明书和实际用户界面,明确软件可供用户调用的全部功能(含安全功能)的纲要。不应出现非量化的、现有技术不能测试或验证的表述,如“该软件采用世界领先技术”“该软件计算功能极其强大”等陈述。
2.1.2使用限制。需要依据产品说明书明确软件的用户使用限制和技术限制。如不同类型用户对功能的使用限制,软件对导入和导出文件的格式及大小的限制等。
2.1.3 输入输出。即处理对象,需要明确软件的输入数据类型(如医学图像、生理参数、体外诊断等数据)、输出结果类型(如处理、测量、分析等结果)。
2.1.4 接口。需要明确数据传输协议、存储格式和接口类型,如硬件接口USB、RS232等,数据接口DICOM、PNG等,应用程序接口API。
2.1.5必备软硬件。需要明确软件正常运行时所必需的其他的医疗器械独立软件和硬件支持,其中软件要明确名称、规格型号和发布版本,硬件要明确名称和规格型号。
2.1.6用户界面。需要明确软件的用户界面类型和用户输入类型,比如菜单、窗口和命令行等。
2.1.7 消息。需要明确软件向用户提供的消息类型和形式,比如警告消息、提醒消息、确认消息等。
2.1.8访问控制。需要明确软件的用户分类、用户身份鉴别方法、用户访问权限控制方法,比如只有用户名和密码匹配成功才能访问软件,软件通过人脸识别验证身份等。
2.1.9版权保护。需要明确软件的版权保护技术和对软件正常使用产生的影响,比如在首次安装软件时需要输入软件注册码,或者在正常使用软件时需要插入硬件加密狗。
2.1.10 运行环境。需要明确软件正常运行所需的典型运行环境,包括硬件配置、外部软件环境、网络条件,如果有客户端、服务器端或云端,都需要明确。
2.1.11 最大并发数。需要明确软件在典型运行环境下实施典型并发操作的最大并发用户数,最大并发患者数。如果软件为单机版软件也需要明确。
2.1.12 性能效率。需要明确软件在典型运行环境下完成典型核心功能的时间特性,若适用还需明确资源利用性和容量。
2.1.13 用户差错防御。需要明确软件对于导致严重后果的用户操作错误的防御能力,比如互斥按钮的设置、防止用户误操作的提示信息等。
2.1.14 可靠性。需要明确软件出错的数据保存、恢复及继续运行能力,即软件在由于程序逻辑出错或用户误操作等原因无法正确运行和传递参数的情况下,能否为用户提供相应数据保存、备份和恢复等。
2.1.15 维护性。需要明确软件向用户提供的维护功能和维护信息的类型,比如是否可以通过日志记录、运行状态报告、失效操作提示等信息告知用户引起软件失效的具体操作事项。
《医疗器械软件注册技术审查指导原则(2022 年修订版)》中规定医疗器械软件的注册申请人需在软件研究资料中提交GB/T 25000.51 的检测报告。现行有效版本为GB/T25000.51-2016《系统与软件工程系统与软件质量要求和评价(SQuaRE)第51 部分:就绪可用软件产品(RUSP)的质量要求和测试细则》[5],标准的核心测试章节为第5 章,包括产品说明要求、用户文档集要求和软件质量要求,其中产品说明要求和用户文档集要求适用于说明书,软件质量要求适用于软件本身,同时“使用质量”不适用。GB/T 25000.10-2016《系统与软件工程系统与软件质量要求和评价(SQuaRE)第10 部分:系统与软件质量模型》[6] 中规定了软件产品质量模型如图2 所示,产品说明要求、用户文档集要求和软件质量要求也主要围绕这八大质量特性展开。
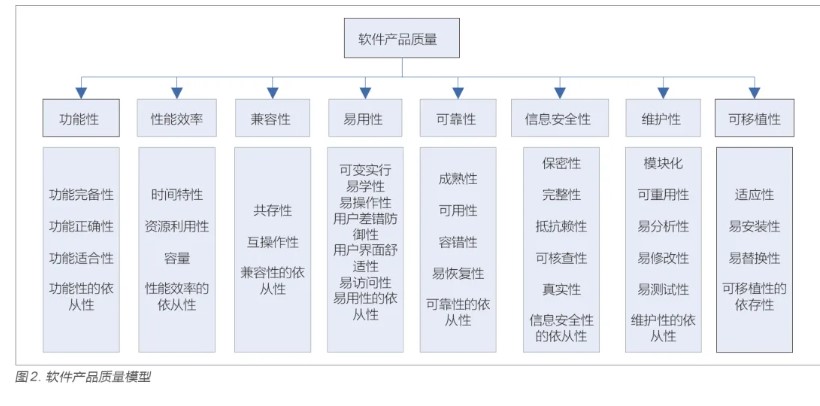
产品说明是陈述软件各种性质的文档,主要目的是帮助潜在的需方在采购前对软件进行适用性评价,包括全部页面信息、数据表等。GB/T 25000.51-2016 中的5.1 节分别从内容、可用性、映射和八大质量特性等多个方面,对软件产品说明进行了规定。
用户文档集是一系列文档的合集,主要目的是帮助和指导用户使用软件,一般可包括用户操作手册、安装手册、需求规格说明和产品设计文档等。GB/T 25000.51-2016中5.2节分别从内容、可用性、正确性、完备性、一致性和七大质量特性等多个方面,对用户文档集进行了规定。
软件质量要求主要针对软件本身,GB/T 25000.51-2016中5.3 节分别从功能性、兼容性、性能效率、易用性、信息安全性、维护性、可靠性和可移植性八大特性对软件产品的质量进行了详细的规定。
专用要求是根据特定用途的医疗器械软件的特点和应用场景制定的专门要求,主要侧重于医疗器械软件的控制精度和准确性。比如YY/T 0973-2016《自动控制式近距离治疗后装设备放射治疗计划系统性能和试验方法》[7] 就规定了放射治疗系统的剂量分布准确性和计算偏差。
安全要求主要是从风险管理和基本安全等角度,针对那些安全性可能受到医疗器械软件影响的测试项目和内容提出的要求。比如YY 9706.108-2021《医用电气设备 第1-8 部分:基本安全和基本性能的通用要求 并列标准:通用要求,医用电气设备和医用电气系统中报警系统的测试和指南》[8]规定了由医疗器械软件来控制的报警系统,其低、中、高优先级报警应符合的要求。
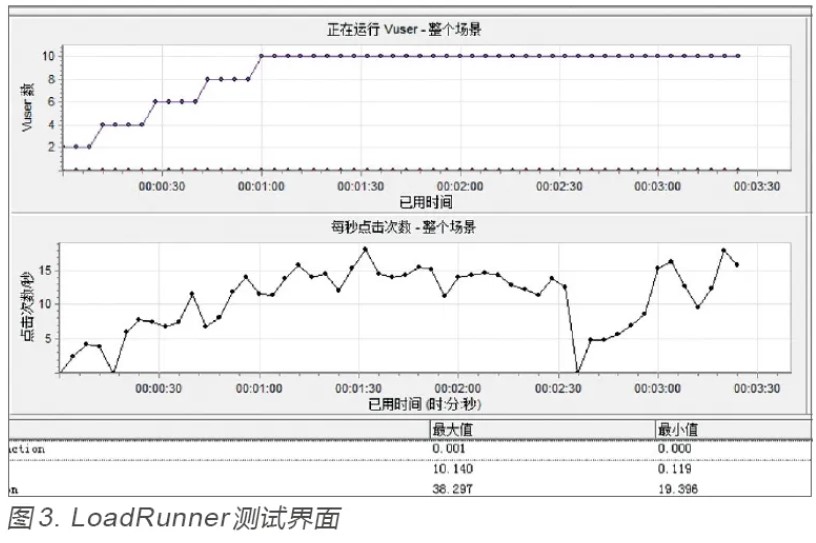
性能测试主要采用并发测试、负载测试、稳定性测试等方法,来考察被测软件的响应时间、并发数、资源利用率和稳定性等性能。测试过程通常需要专业工具来辅助完成,比如惠普公司推出的LoadRunner 就是一款常用的性能测试工具。它主要包括三个组件:虚拟用户生成器(Vuser Generator)、控制器(Controller)和分析器 (Analysis)[10]。通过虚拟用户生成器可以录制、调试Vuser 脚本,利用控制器可以进行模拟场景的设计和执行,最后借助分析器收集、存储和分析测试数据,并以图形和表格的形式展示测试结果,如用户数、每秒点击次数、吞吐量、事务平均用时等,LoadRunner 测试界面如图3所示,实现对被测软件和服务器的自动化测试。
想要了解更多请前往医疗质量检测技术展
文章来源:中国医疗器械信息
若涉及侵权,请立刻联系删除
关键字:









