在医疗器械注册申报流程中,同品种比对作为一种关键的临床评价方法,一般是企业优先选择的临床评价方法。那么在医疗器械注册过程中哪些产品适合做同品种比对?如何做?本篇将进行简单介绍。
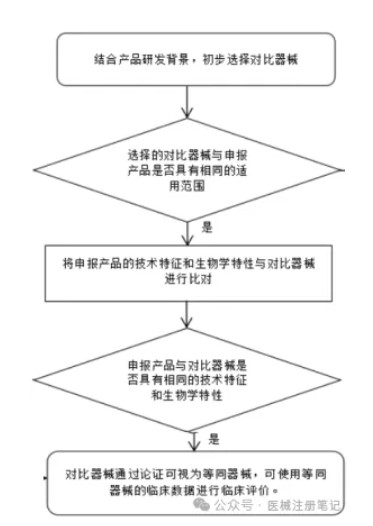
同品种比对核心路径:
一是依托等同器械的临床数据实施全面的临床评价;
二是借助可比器械的临床数据,进行有针对性的部分临床评价。
图片来源:医械注册笔记
哪些产品适宜采用同品种比对方式?
1. 功能相似性:产品跟市场上已有的同类产品在功能上具有高度相似性。
2. 设计一致性:产品设计、结构和工作原理跟同类产品保持一致或相似。
3. 生物相容性:使用的材料应跟同类产品相同或者有相似的生物相容性。
4. 预期用途一致:产品的预期用途应跟同类产品相同或非常接近。
5. 临床使用经验:同类产品应具有充分的临床使用经验和数据支持。
6. 风险等级匹配:申报产品的风险等级跟同类产品匹配。
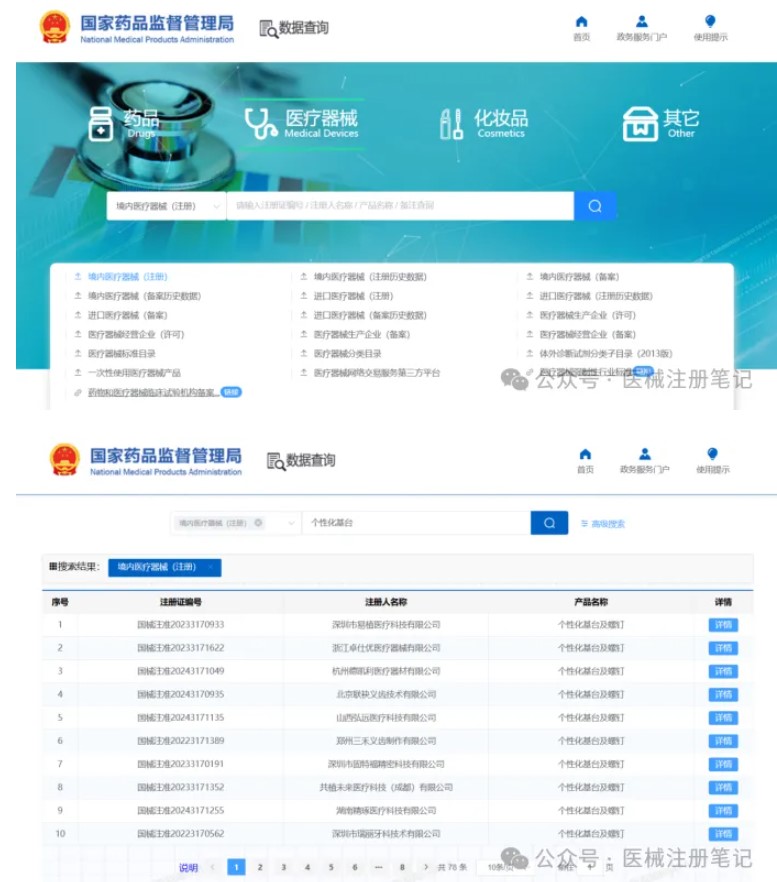
1.选择同品种医疗器械
图片来源:医械注册笔记
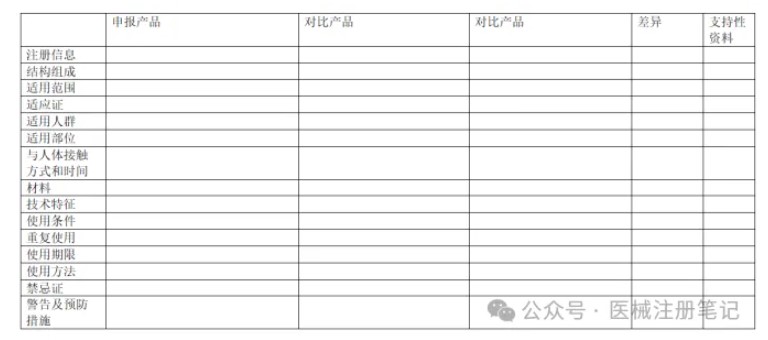
2.申报产品与同品种医疗器械差异性对比
图片来源:医械注册笔记
3.同类医疗器械临床数据检索
4、编写临床评价报告
想要了解更多请前往上海医疗测试仪器展
文章来源:医械注册笔记
若涉及侵权,请立刻联系删除
关键字:









