由医疗器械制造展知晓,在医疗器械的开发过程中,确保产品的可靠性和安全性是至关重要的任务。为了实现这一目标,失效模式和影响分析(FMEA)成为了设计和风险管理的核心工具之一。FMEA 是一种系统的方法,通过识别和评估潜在的失效模式及其对系统、用户和环境的影响,帮助开发团队预防和减少产品故障。
图片来源:MedTechUX
本文将详细介绍 FMEA 分析的各个步骤,从确定范围和目标,到评估和排序故障模式,直至实施和验证纠正措施。通过这一系统的过程,医疗器械开发者可以在设计的早期阶段识别并解决潜在的风险,确保产品的安全性和有效性。

FMEA 的第一步是确定分析的范围和目标。
需要明确要评估的系统、子系统或组件,其执行的功能和要求,以及关注的故障模式和影响。还应定义工作假设和限制条件。这将有助于将 FMEA 的重点放在医疗设备最相关和最关键的方面。

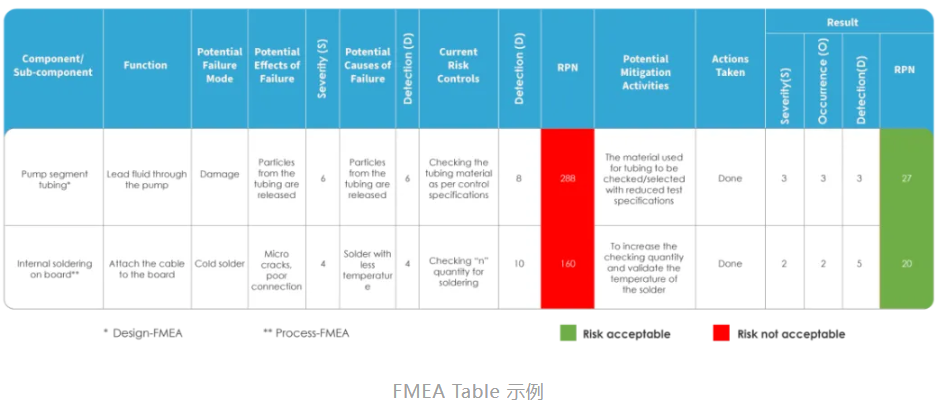
FMEA 的下一步是为系统的每个功能和要求确定潜在的失效模式和影响。
失效模式是指系统无法执行其预期功能的方式,而影响是指失效对系统、用户或环境造成的后果。可以使用各种信息来源来识别失效模式和影响,如历史数据、客户反馈、设计规范、测试结果、风险管理计划和头脑风暴会议。应在 FMEA 表格或电子表格中记录每种故障模式和影响,以及故障原因和机制。

FMEA 的第三步是评估每种故障模式的严重性(Severity)、发生率(Occurence)和检测率(Detection)。
严重性是指故障模式可能造成的危害或影响程度,发生率是指故障模式可能发生的频率,检测率是指在故障模式造成危害之前检测或预防故障模式的能力或难度。可以使用 1 到 10 等数字标度对每个因素进行评级,也可以使用低、中或高等定性标度。在评估这些因素时,还应考虑监管要求和客户期望。

FMEA 的第四步是计算风险优先级编号(RPN)并对故障模式进行排序。
RPN 是严重性、发生率和检测等级的乘积,代表了每种故障模式的相对风险。RPN 越高,风险越大。可以使用 RPN 对故障模式从高到低进行排序,并对需要采取纠正措施或进一步调查的故障模式进行优先排序。除此之外,应根据自己的产品特性制定一个阈值或标准,以决定哪些故障模式是可接受的,哪些是不可接受的。

FMEA 的第五个步骤是针对不可接受或高风险的失效模式实施并验证纠正措施。
纠正措施是为消除、减少或控制故障模式及其影响而采取的措施。这些措施可以包括更改设计、改进流程、测试方法、预防性维护、培训或记录。制造商应记录每项纠正措施的理由、责任方和时间表,并验证其有效性和对 RPN 的影响。加入纠正措施后,还应更新 FMEA 表格,加入修订后的评级和 RPN。

FMEA 的最后一步是在整个医疗器械开发生命周期中审查和更新 FMEA。
FMEA 不是一次性活动,而是一个不断持续和迭代的过程,它应反映系统中发生的变化和反馈,如新功能、要求、失效模式、影响、原因或纠正措施。需要定期审查 FMEA,例如在每次设计迭代、测试阶段或客户反馈之后,并对其进行相应的更新。也需要记录对 FMEA 所做的更改和修订,并将其传达给各个相关利益者。
想要了解更多请前往医疗器械制造展
文章来源: MedTechUX
若涉及侵权,请立刻联系删除
关键字:









