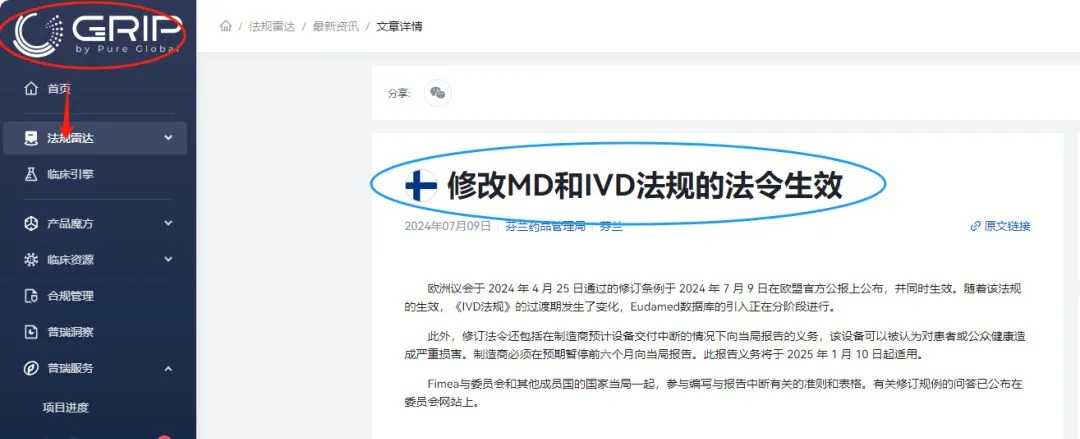
2024年7月9日,IVDR延期修订法案
在欧盟Official Journal上正式发布
一
条例具体内容如下:

过渡期延长至:
• 2027年12月31日(D类器械)
• 2028年12月31日(C类器械)
• 2029年12月31日(B类和A类无菌器械)
• 提醒:A类器械(A类无菌器械除外)没有过渡期。IVDR自2022年5月26日起适用于这些器械。
图片来源:Pure Global 普瑞纯证
二
此外,制造商和公告机构必须在申请享受延长过渡期的截止日期后四个月内签署书面协议,即
三
1.针对无IVDD CE自我符合性申明或者IVDD CE证书的器械,或者IVDR下属于Class A类非无菌器
械,需要立刻申请IVDR,以便进入欧洲市场。
2.针对已有IVDD CE自我符合性申明且在IVDR下属B/C/D类的器械,或者IVDD CE证书的器械,需
要完成以下动作,以便原有IVDD下的器械能继续进入和投放欧洲市场:
四
既然申请和签署协议期间不需要提供所有产品的技术文档,是否意味着制造商还可以等一等呢?不尽然。欧盟还是希望制造商尽快准备产品的技术文档,以尽快完成IVDR转换。公告机构也会要求制造商在申请期间提供部分产品的技术文档。且此过渡期主要是给公告机构预留合适的时间进行符合性评价。扣除公告机构所需的时间,留给制造商的时间已经不多了。
⭐所以制造商还是应该尽快完成IVDR转换的相关工作,包括质量体系的转化更新,和产品技术文档的转换更新。比如IVDD CE证书下。
除此之外,该条例也要求制造商、公告机构、欧代等经济运营商要根据EUDMED各模块上线进度来执行EUDMED相关要求。
想要了解更多过渡期的IVDR转换策略,欢迎咨询普瑞。
文章来源:Pure Global 普瑞纯证
若涉及侵权,请立刻联系删除
关键词:









